Effects of environmental conditions and exogenous silicon concentration on absorption and allocation of silicon in cucumber
-
摘要:目的
研究不同环境条件和根际硅水平对黄瓜硅主动和被动吸收过程的影响。
方法以‘新泰密刺’黄瓜为试材,在人工气候室内采用水培法,设置4种环境条件:1) T1,昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s);2) T2,昼/夜温度22℃/12℃、相对湿度85%/95%,光照强度600 μmol/(m2·s);3) T3,昼/夜温度28℃/18℃,相对湿度55%/65%、光照强度300 μmol/(m2·s);4) T4,昼/夜温度28℃/18℃、相对湿度55%/65%、光照强度600 μmol/(m2·s)。硅吸收动力学试验营养液设置为10个Si处理浓度,依次为0、0.085、0.17、0.34、0.51、0.68、0.85、1.02、1.36、1.70 mmol/L,硅吸收分配试验设置3个硅浓度为0.085、0.17、1.7 mmol/L。
结果不同环境条件下黄瓜对硅的吸收速率及器官中硅含量均为T4 > T3 > T2 > T1处理;低外源硅浓度 (0.085和0.17 mmol/L) 下,黄瓜硅吸收在T1、T2、T3处理环境中以主动过程为主,在T4处理环境中以被动过程为主;高外源硅浓度 (1.7 mmol/L) 下,4种环境条件下的硅吸收均以被动过程为主;相同温度条件,强光下被动吸收的占比大于弱光,相同光照条件,高温下被动吸收的占比大于低温;相同环境条件下,随着外源硅浓度的增加,黄瓜对硅的被动吸收量和总吸收量均呈上升趋势,且被动吸收的占比增加。
结论环境条件和外源硅水平影响黄瓜对硅的主动和被动吸收过程,高温、强光及高外源硅浓度提高黄瓜被动吸收硅的比例。
Abstract:ObjectivesThis experiment was conducted to study the effects of environmental conditions and silicon supplying levels on the active and passive absorption process of Si by cucumber.
MethodsUsing ‘Xintaimici’ cucumber as the tested material, soilless culture methods were adopted in an artificial climate chamber. Four environmental conditions were set up: 1) T1, day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); 2) T2, day/night temperature 22℃/12℃, ralative humidity 85%/95%, light intensity 600 μmol/(m2·s); 3) T3, day/night temperature 28℃/18℃, ralative humidity 55%/65%, light intensity 300 μmol/(m2·s); 4) T4, day/night temperature 28℃/18℃, ralative humidity 55%/65%, light intensity 600 μmol/(m2·s). For the experiment of Si absorption dynamics, 10 levels were set up: 0, 0.085, 0.17, 0.34, 0.51, 0.68, 0.85, 1.02, 1.36, 1.70 mmol/L. For the experiment of Si absorption and distribution, three concentrations of 0.085, 0.17, 1.7 mmol/L were set up.
ResultsAmong 4 environmental conditions, the silicon absorption rate and silicon content in organs were all T4>T3>T2>T1. At lower silicon concentration (0.085 and 0.17 mmol/L), the silicon absorption of cucumber was mainly active process in T1, T2 and T3, and passive process in T4; at higher silicon concentrations (1.7 mmol/L), however, passive absorption was dominant under all the four environmental conditions. At same temperature, the proportion of passive absorption under strong light was greater than that under weak light. Under the same light intensity, the proportion of passive absorption at high temperature was higher than that at low temperature. Under same environmental conditions, with the increase of the exogenous silicon concentration, both the passive absorption and total absorption of silicon in cucumber increased, and the proportion of passive absorption increased.
ConclusionsBoth environmental conditions and exogenous silicon concentrations affect the active and passive absorption of cucumber to silicon, high temperature, strong light and high silicon concentration increase the proportion of passive absorption.
-
Keywords:
- cucumber /
- environmental condition /
- silicon concentration /
- active absorption /
- passive absorption
-
黄瓜 (Cucumis sativus L.) 是设施栽培的主要果菜之一,果实品质性状包括商品品质、营养品质和风味品质[1],而果实表面蜡粉是其重要的商品品质性状。生产实践中发现,黄瓜果面蜡粉量受栽培环境影响很大,温度、湿度、光照条件均会引起蜡粉量的不同[2–4]。已有研究表明,黄瓜果面蜡粉形成在一定程度上取决于植株对硅的吸收分配特性,果面蜡粉量随着硅营养的增减而显著增加或减少[5-6]。因此,环境条件影响黄瓜果实表面蜡粉形成可能源于植株对硅吸收运转状况的改变[7-8]。
硅是地球表面第二大元素,也是大多数高等植物生长的有益元素[9]。关于植物吸收运转硅的机制,Takahashi等[10]提出了主动吸收、被动吸收、拒硅三种类型。水稻、小麦、大麦等为主动吸收类型,燕麦、黄瓜、西瓜、草毒和大豆等为被动吸收类型,番茄和扁豆为拒硅类型[11]。进一步研究发现,黄瓜根部对硅的吸收主要是由硅转运蛋白介导的主动运输过程,受低温和代谢抑制剂的影响[12-13];而硅向地上部的运转则主要是一个被动扩散过程[14]。因此,黄瓜对硅的吸收包含了主动和被动两个过程[15]。但是,环境条件和外源硅浓度对黄瓜硅主动和被动吸收过程的影响研究较少。
为此,本试验以‘新泰密刺’黄瓜为试材,在人工气候室水培条件下,研究了不同环境条件和外源硅浓度对黄瓜幼苗硅吸收过程的影响,旨在探明环境条件和外源硅浓度影响黄瓜硅吸收的机制以及与果面蜡粉形成的关系,为黄瓜优质生产提供理论依据。
1. 材料与方法
1.1 试验材料
试验于2017年6—12月在山东农业大学园艺科学与工程学院人工气候室内进行。供试黄瓜品种为‘新泰密刺’ (新泰祥云种业有限公司),种子经温汤浸种、催芽后,播种在装有草炭和蛭石 (2∶1) 混合基质的50孔穴盘中。一叶一心时,选取长势一致的幼苗仔细洗根,移栽至装有6 L山崎黄瓜专用配方营养液的塑料盒 (长42 cm × 宽32 cm × 高12 cm) 中,每盒6株,转入人工气候室内继续培养。期间调节营养液pH为6.0~6.5,24 h不间断通气,每3天更换一次营养液。
1.2 试验设计
1.2.1 不同环境条件下黄瓜的硅吸收动力学特性
幼苗培养至五叶一心时,放置于4种环境条件 (表1) 下进行不同硅浓度处理,供试硅源为Na2SiO3·9H2O。先用去离子水饥饿处理24 h,然后进行硅吸收试验。设置10个硅浓度,分别为0、0.085、0.17、0.34、0.51、0.68、0.85、1.02、1.36、1.70 mmol/L。采用盛有200 mL营养液的棕色聚乙烯瓶培养,每瓶1株,吸收时间6 h,然后取营养液测定硅浓度,取样植株测定干鲜重。每处理重复3次。
表 1 环境条件Table 1. Environment conditions处理
Treatment温度
Temperature
(℃)湿度
Humidity
(%)光照强度
Light intensity
[μmol/(m2·s)]T1 22/12 85/95 300 T2 22/12 85/95 600 T3 28/18 55/65 300 T4 28/18 55/65 600 1.2.2 环境条件和外源硅浓度对黄瓜硅吸收分配的影响
将一叶一心幼苗放置于人工气候室4种环境条件下,分别进行不同硅浓度处理。环境条件和供试硅源同1.2.1,光周期为12 h,硅浓度为0.085、0.17和1.7 mmol/L。五叶一心时取样,测定不同器官硅含量。
1.2.3 环境条件和外源硅浓度对黄瓜主动和被动吸收过程的影响
将培养至五叶一心的黄瓜幼苗放置于4种环境条件下进行不同硅浓度处理,环境条件、供试硅源和硅浓度设置同1.2.2。采用盛有200 mL营养液的棕色聚乙烯瓶培养,每瓶1株,培养时间12 h,分别于开始处理后2、4、6、8、10、12 h时取样营养液,测定硅浓度,取植株样测定干鲜重。每处理重复3次。
1.3 测定项目与方法
离子吸收速率计算参考李惠霞等[16]方法,作图法求动力学参数[17];硅含量测定采用钼蓝比色法[18];根系活力测定采用氯化三苯基四氮唑 (TTC) 法[19]。
1.4 数据处理
采用Microsoft Excel 2010和Sigmaplot 10.0进行数据处理和作图,采用DPS7.05软件进行差异显著性检验。
2. 结果与分析
2.1 不同环境条件下黄瓜的硅吸收动力学特性
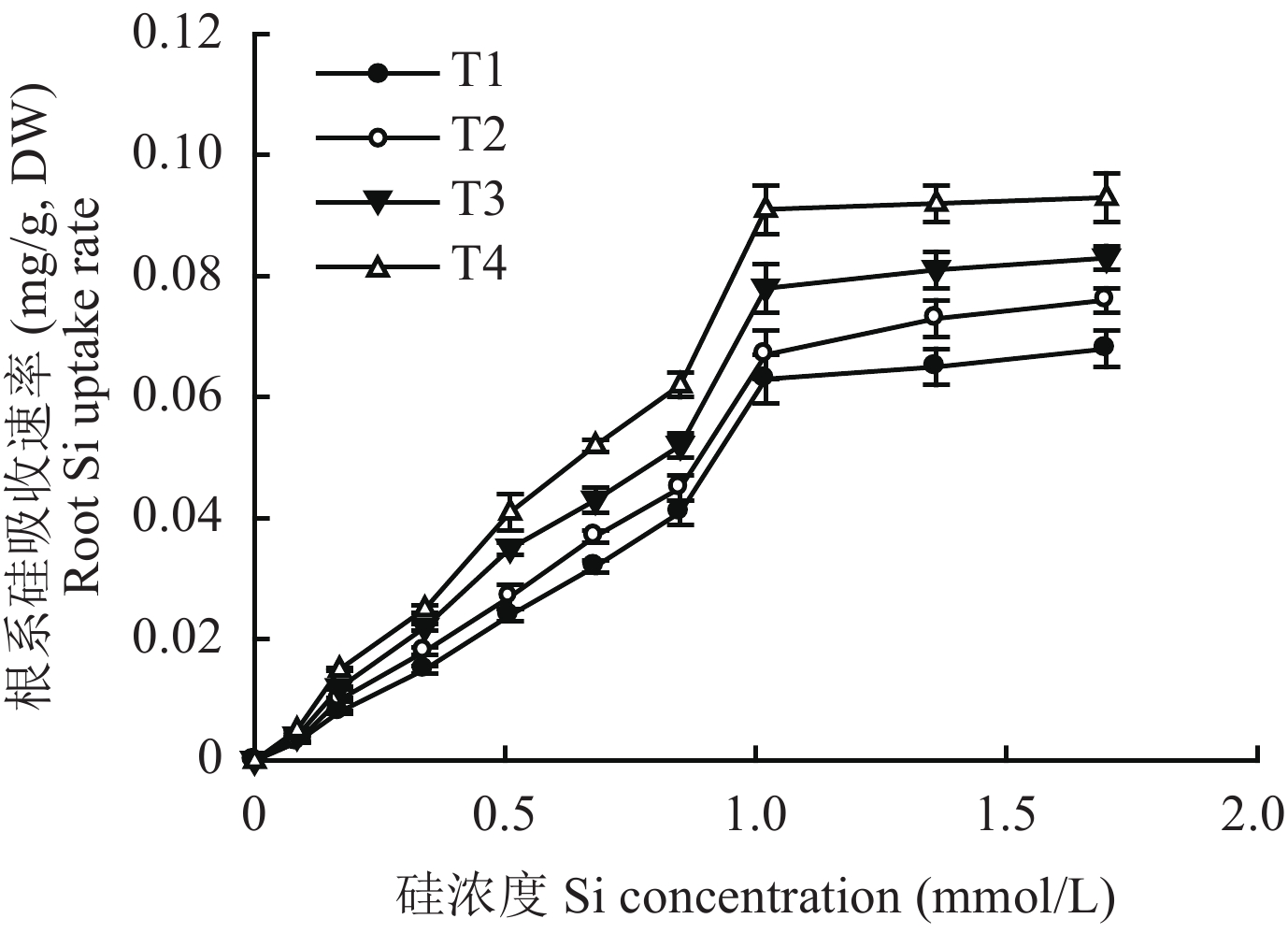
由图1可知,黄瓜硅吸收速率随外界硅浓度的变化符合Michaelis-Menten酶促动力学模式。硅浓度较低时,4种环境条件下的硅吸收速率均随外界硅浓度升高呈线性增加;硅浓度达到一定水平时,硅吸收速率几乎不再增加。相同硅浓度,硅吸收速率大小顺序为T4 > T3 > T2 > T1。进一步分析表明,Km值和Cmin值大小顺序均为T4 < T3 < T2 < T1,Vmax值大小顺序为T4 > T3 > T2 > T1 (表2)。这说明不同环境条件下黄瓜吸收硅的能力不同,高温和强光促进硅的吸收。
![]() 图 1 不同环境条件下黄瓜硅吸收速率随外界硅浓度的变化曲线[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s).]Figure 1. Silicon uptake rate of cucumber under external silicon supplies in different environmental conditions表 2 不同环境条件下黄瓜的Km、Vmax及Cmin值Table 2. Km、Vmax and Cmin values of cucumber in different environments
图 1 不同环境条件下黄瓜硅吸收速率随外界硅浓度的变化曲线[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s).]Figure 1. Silicon uptake rate of cucumber under external silicon supplies in different environmental conditions表 2 不同环境条件下黄瓜的Km、Vmax及Cmin值Table 2. Km、Vmax and Cmin values of cucumber in different environments处理
TreatmentVmax
(mmol/L)Km
(mg/g,DW)Cmin
(mmol/L)T1 0.071 c 0.67 a 0.058 a T2 0.078c 0.63 ab 0.051 a T3 0.085 b 0.58 b 0.038 b T4 0.094 a 0.56 b 0.030 b 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in the same column indicate significant difference among treatments (P<0.05). 2.2 不同环境条件和外源硅浓度对黄瓜硅吸收分配的影响
由表3可以看出,不加硅处理的黄瓜器官硅含量较低,加硅后硅含量显著升高,并且随着硅浓度增加,硅含量呈上升趋势。相同环境条件下,黄瓜各器官硅含量均表现为叶片 > 根系 > 茎。相同硅浓度,各器官中硅含量均表现为T4 > T3 > T2 > T1,其中T4条件下1.7 mmol/L 加硅处理叶片硅含量比T3、T2和T1分别增加21.43%、54.92%和110.05%,说明高温和强光促进了黄瓜对硅的吸收。
表 3 不同环境条件和外源硅供应水平下黄瓜器官硅含量 (mg/g)Table 3. Silicon contents in cucumber organs under different environmental conditions and exogenous silicon supply levels器官
Organs硅浓度 (mmol/L)
Si supplyT1 T2 T3 T4 根系 Root 0 0.25 ± 0.02 c 0.31 ± 0.04 bc 0.35 ± 0.01 b 0.40 ± 0.01 a 0.085 0.28 ± 0.02 b 0.34 ± 0.04 b 0.50 ± 0.03 a 0.54 ± 0.01 a 0.17 0.64 ± 0.05 c 0.76 ± 0.04 c 1.11 ± 0.05 b 1.30 ± 0.01 a 1.7 1.36 ± 0.05 d 1.53 ± 0.02 c 2.27 ± 0.08 b 2.50 ± 0.04 a 茎 Stem 0 0.10 ± 0.03 b 0.11 ± 0.02 ab 0.12 ± 0.01 a 0.13 ± 0.01 a 0.085 0.17 ± 0.01 c 0.19 ± 0.01 bc 0.21 ± 0.01 b 0.23 ± 0.02 a 0.17 0.26 ± 0.02 c 0.30 ± 0.02 bc 0.34 ± 0.02 ab 0.37 ± 0.05 a 1.7 1.09 ± 0.09 a 1.16 ± 0.04 ab 1.19 ± 0.02 b 1.26 ± 0.02 a 叶片 Leaf 0 0.21 ± 0.01 c 0.26 ± 0.02 b 0.30 ± 0.02 ab 0.33 ± 0.02 a 0.085 0.30 ± 0.05 c 0.33 ± 0.02 c 0.46 ± 0.01 b 0.54 ± 0.01 a 0.17 1.13 ± 0.04 d 1.38 ± 0.07 c 1.63 ± 0.13 b 1.93 ± 0.16 a 1.7 6.07 ± 0.03 d 8.23 ± 0.05 c 10.50 ± 0.28 b 12.75 ± 0.10 a 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s); T3—28℃/18℃, 55%/65%, 300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). 同行数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in the same row indicate significant difference between treatments (P<0.05). 2.3 不同环境条件和外源硅浓度对黄瓜根系活力的影响
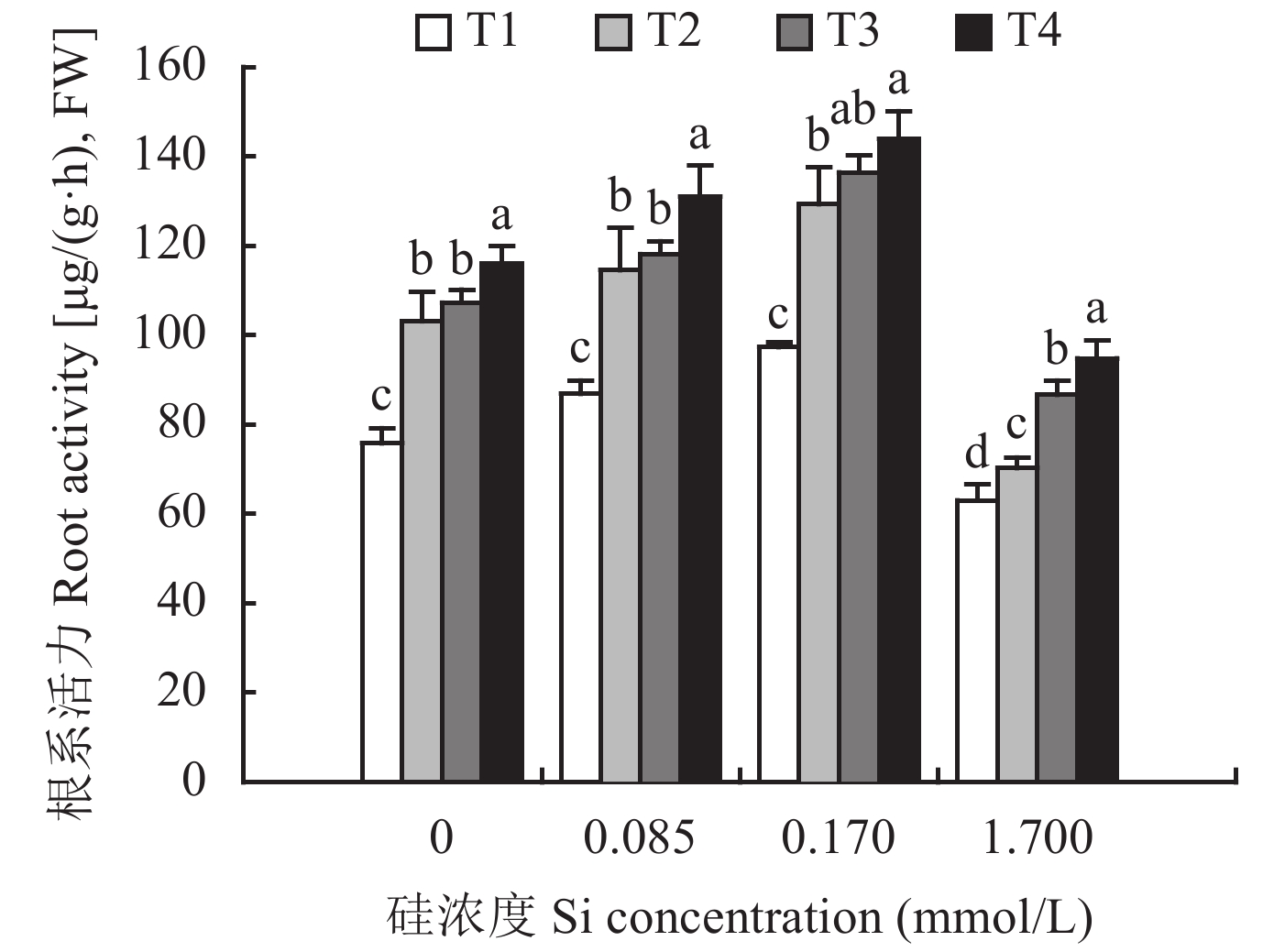
图2表明,与不加硅处理相比,0.085 mmol/L和0.17 mmol/L加硅处理显著增强了根系活力,而1.7 mmol/L处理却导致根系活力显著降低。相同外源硅浓度,不同环境条件下根系活力大小顺序均为T4 > T3 > T2 > T1,其中以T4环境、外源硅浓度为0.17 mmol/L时黄瓜根系活力最大。
![]() 图 2 环境条件和外源硅对黄瓜根系活力的影响[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s). 柱上不同字母表示同一硅浓度不同环境条件下差异显著 (P < 0.05) Different letters above the bars indicate significant difference between treatments (P<0.05).]Figure 2. Effect of environmental conditions and exogenous silicon on cucumber root activity
图 2 环境条件和外源硅对黄瓜根系活力的影响[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s). 柱上不同字母表示同一硅浓度不同环境条件下差异显著 (P < 0.05) Different letters above the bars indicate significant difference between treatments (P<0.05).]Figure 2. Effect of environmental conditions and exogenous silicon on cucumber root activity2.4 不同环境条件和外源硅浓度对黄瓜主动和被动吸收过程的影响
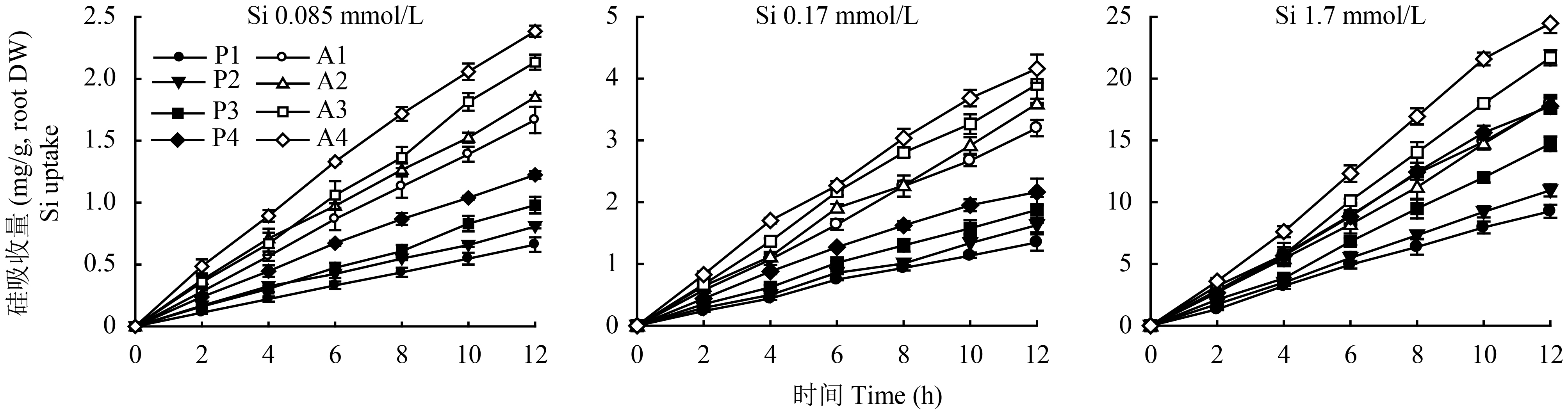
外源硅浓度为0.085 mmol/L时,随着吸收时间延长,黄瓜被动吸硅量和总吸硅量均明显增加,且以T4环境下吸收量最大 (图3)。其中,在T1、T2、T3环境下以主动吸收为主,在T4环境下则以被动吸收为主。低温条件下,T1 (弱光) 和T2 (强光) 引起的被动吸收占比分别为39.5%和42.9%;高温条件下,T3 (弱光) 和T4 (强光) 引起的被动吸收占比分别为45.9%和51.3%;弱光条件下,T1 (低温) 和T3 (高温) 引起的被动吸收占比分别为39.5%和45.9%;强光条件下,T2 (低温) 和T4 (高温) 条件引起的被动吸收占比分别为42.9%和51.3%。可见,高温和强光均可提高黄瓜对硅的被动吸收量和总吸收量,增加被动吸收的占比,且温度对被动吸收占比的影响大于光强。
![]() 图 3 不同环境条件下黄瓜硅吸收随处理时间的变化[注(Note):P—通过蒸腾流计算的硅吸收量,代表被动吸收量Silicon absorption calculated by transpiration streams,representing passive absorption;A—测量的硅吸收,代表总吸收量Measured Si absorption,representing total absorption;P和A后的数字表示相应的T1、T2、T3、T4环境条件下的吸收Digitals after P and A represent the Si absorption at corresponding environmental conditions.]Figure 3. Dynamics of Si absorption of cucumber with treating time under different environmental conditions at Si supply level
图 3 不同环境条件下黄瓜硅吸收随处理时间的变化[注(Note):P—通过蒸腾流计算的硅吸收量,代表被动吸收量Silicon absorption calculated by transpiration streams,representing passive absorption;A—测量的硅吸收,代表总吸收量Measured Si absorption,representing total absorption;P和A后的数字表示相应的T1、T2、T3、T4环境条件下的吸收Digitals after P and A represent the Si absorption at corresponding environmental conditions.]Figure 3. Dynamics of Si absorption of cucumber with treating time under different environmental conditions at Si supply level外源硅浓度为0.17 mmol/L时,黄瓜对硅的吸收规律与0.085 mmol/L相似,同样表现为温度相同时,强光下被动吸收占比大于弱光;光强相同时,高温下被动吸收占比大于低温,高温、强光提高了黄瓜对硅的总吸收量和被动吸收量以及被动吸收所占的比例。
外源硅浓度为1.7 mmol/L时,黄瓜对硅的吸收规律虽与0.085和0.17 mmol/L相似,但在4种环境条件下对硅的吸收均以被动吸收为主,并且外源硅浓度的增加促进了黄瓜对硅的被动吸收以及被动吸收所占比例。
表 4 不同环境条件和硅浓度下黄瓜被动吸收和总吸收及被动吸收占比Table 4. Passive absorption and percentage of passive absorption in cumber at different environments and Si supply levels处理
TreatmentsSi 0.085 mmol/L Si 0.17 mmol/L Si 1.7 mmol/L P
(mg/g)A
(mg/g)占比 (%)
PercentageP
(mg/g)A
(mg/g)占比 (%)
PercentageP
(mg/g)A
(mg/g)占比 (%)
PercentageT1 0.66 ± 0.06 d 1.67 ± 0.11 d 39.5 ± 1.0 d 1.35 ± 0.13 d 3.20 ± 0.13 d 42.1 ± 0.6 d 9.26 ± 0.53 d 17.97 ± 0.53 c 51.5 ± 1.0 d T2 0.81 ± 0.02 c 1.85 ± 0.02 c 42.9 ± 0.4 c 1.63 ± 0.12 c 3.59 ± 0.01 c 45.3 ± 0.3 c 10.95 ± 0.49 c 17.98 ± 0.71 c 60.9 ± 0.8 c T3 0.98 ± 0.07 b 2.13 ± 0.06 b 45.9 ± 0.4 b 1.87 ± 0.21 b 3.90 ± 0.23 b 48.0 ± 0.4 b 14.72 ± 0.59 b 21.69 ± 0.62 b 67.9 ± 2.0 b T4 1.22 ± 0.03 a 2.38 ± 0.05 a 51.3 ± 0.5 a 2.16 ± 0.22 a 4.16 ± 0.23 a 52.0 ± 0.4 a 17.76 ± 0.62 a 24.47 ± 0.89 a 72.6 ± 0.4 a 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s); T3—28℃/18℃, 55%/65%, 300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). P—通过蒸腾流计算的硅吸收量,代表被动吸收量 Silicon absorption calculated by transpiration streams, representing passive absorption; A—测量的硅吸收,代表总吸收量 Measured Si absorption, representing total absorption. 由表4可知,相同环境条件下,随着外源硅浓度的增加,黄瓜对硅的被动吸收量和总吸收量均呈上升趋势,且被动吸收所占比例也增加。高温和强光促进了黄瓜对硅的被动吸收,增加外源硅浓度也可以提高黄瓜对硅的被动吸收占比。
3. 讨论
前人研究表明,黄瓜根部对硅的吸收是一个由硅转运蛋白介导的主动运输过程,且受低温和代谢抑制剂的显著影响,而地上部硅的积累则是一个被动扩散过程[13–14]。本试验通过吸收动力学研究发现,黄瓜硅吸收速率初期随着外界硅浓度升高呈线型增加,当硅浓度达到一定水平后,硅吸收速率几乎不再增加;而且4种环境条件下硅吸收速率高低顺序为T4 > T3 > T2 > T1,说明黄瓜对硅的吸收受蛋白质载体调控并可受外界温度或光照条件影响[20]。环境条件和外源硅浓度显著影响黄瓜不同器官中硅含量,相同环境条件和外源硅浓度下,叶片中硅含量显著高于茎和根系,以T4条件下各器官中硅含量最高,符合硅通过木质部蒸腾流向地上部运输,并最终聚集在蒸腾速率较高部位的特点[21–22]。环境条件可以通过影响蒸腾作用,进而影响植物对养分的吸收。本试验中,环境条件对黄瓜被动吸收硅具有极显著影响,高温条件 (T3和T4) 下硅被动吸收的占比大于低温条件 (T1和T2),说明高温可能通过增加气孔导度、加大叶片内外水汽压饱和差促进蒸腾作用[23],增加被动吸收的量和比例。强光条件 (T2和T4) 下被动吸收占比大于弱光条件 (T1和T3),同样与提高了气孔导度和蒸腾作用有关。低湿条件 (T3和T4) 下被动吸收占比大于高湿条件 (T1和T2),是因为空气湿度增大导致叶–气水汽压饱和差减少,降低叶片蒸腾速率所致[24]。因此,环境条件主要通过蒸腾作用来影响黄瓜对硅元素的吸收转运过程。黄瓜果面蜡粉的主要成分是二氧化硅[25],这可在一定程度上解释高温强光低湿条件下黄瓜蜡粉增多的原因。
外源硅浓度对黄瓜主动和被动吸收硅也具有显著影响。硅浓度为0.085和0.17 mmol/L时,T1、T2和T3条件下黄瓜吸收运转硅以主动过程为主,T4条件下则以被动过程为主;外源硅浓度为1.7 mmol/L时,4种环境条件下的硅吸收运转均以被动过程为主,并且随着硅浓度升高,被动吸收的占比增加。这可能由于外源硅浓度升高,溶液和根系中的硅浓度梯度加大,有助于硅元素较快地顺电化学势浓度梯度进入根系[26];此外,与主动吸收有关的硅转运蛋白相关基因的表达也会受到低浓度硅促进和高浓度硅抑制[27]。有研究表明,低浓度下,水稻和小麦等植物对硅的吸收以主动吸收为主,而在高浓度下,水稻被动吸收的硅增多,而小麦则主要是被动吸收[10],与本文研究结果一致。
4. 结论
黄瓜对硅的主动吸收和被动吸收过程受外源硅浓度和环境条件的显著影响,高温强光低湿环境及高外源硅浓度均可提高黄瓜对硅的吸收总量及被动吸收的比例。
-
图 1 不同环境条件下黄瓜硅吸收速率随外界硅浓度的变化曲线
[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s).]
Figure 1. Silicon uptake rate of cucumber under external silicon supplies in different environmental conditions
图 2 环境条件和外源硅对黄瓜根系活力的影响
[注(Note):T1—昼/夜温度22℃/12℃、相对湿度85%/95%、光照强度300 μmol/(m2·s) Day/night temperature 22℃/12℃,relative humidity 85%/95%,light intensity 300 μmol/(m2·s);T2—22℃/12℃,85%/95%,600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s);T4—28℃/18℃,55%/65%,600 μmol/(m2·s). 柱上不同字母表示同一硅浓度不同环境条件下差异显著 (P < 0.05) Different letters above the bars indicate significant difference between treatments (P<0.05).]
Figure 2. Effect of environmental conditions and exogenous silicon on cucumber root activity
图 3 不同环境条件下黄瓜硅吸收随处理时间的变化
[注(Note):P—通过蒸腾流计算的硅吸收量,代表被动吸收量Silicon absorption calculated by transpiration streams,representing passive absorption;A—测量的硅吸收,代表总吸收量Measured Si absorption,representing total absorption;P和A后的数字表示相应的T1、T2、T3、T4环境条件下的吸收Digitals after P and A represent the Si absorption at corresponding environmental conditions.]
Figure 3. Dynamics of Si absorption of cucumber with treating time under different environmental conditions at Si supply level
表 1 环境条件
Table 1 Environment conditions
处理
Treatment温度
Temperature
(℃)湿度
Humidity
(%)光照强度
Light intensity
[μmol/(m2·s)]T1 22/12 85/95 300 T2 22/12 85/95 600 T3 28/18 55/65 300 T4 28/18 55/65 600 表 2 不同环境条件下黄瓜的Km、Vmax及Cmin值
Table 2 Km、Vmax and Cmin values of cucumber in different environments
处理
TreatmentVmax
(mmol/L)Km
(mg/g,DW)Cmin
(mmol/L)T1 0.071 c 0.67 a 0.058 a T2 0.078c 0.63 ab 0.051 a T3 0.085 b 0.58 b 0.038 b T4 0.094 a 0.56 b 0.030 b 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s);T3—28℃/18℃,55%/65%,300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in the same column indicate significant difference among treatments (P<0.05). 表 3 不同环境条件和外源硅供应水平下黄瓜器官硅含量 (mg/g)
Table 3 Silicon contents in cucumber organs under different environmental conditions and exogenous silicon supply levels
器官
Organs硅浓度 (mmol/L)
Si supplyT1 T2 T3 T4 根系 Root 0 0.25 ± 0.02 c 0.31 ± 0.04 bc 0.35 ± 0.01 b 0.40 ± 0.01 a 0.085 0.28 ± 0.02 b 0.34 ± 0.04 b 0.50 ± 0.03 a 0.54 ± 0.01 a 0.17 0.64 ± 0.05 c 0.76 ± 0.04 c 1.11 ± 0.05 b 1.30 ± 0.01 a 1.7 1.36 ± 0.05 d 1.53 ± 0.02 c 2.27 ± 0.08 b 2.50 ± 0.04 a 茎 Stem 0 0.10 ± 0.03 b 0.11 ± 0.02 ab 0.12 ± 0.01 a 0.13 ± 0.01 a 0.085 0.17 ± 0.01 c 0.19 ± 0.01 bc 0.21 ± 0.01 b 0.23 ± 0.02 a 0.17 0.26 ± 0.02 c 0.30 ± 0.02 bc 0.34 ± 0.02 ab 0.37 ± 0.05 a 1.7 1.09 ± 0.09 a 1.16 ± 0.04 ab 1.19 ± 0.02 b 1.26 ± 0.02 a 叶片 Leaf 0 0.21 ± 0.01 c 0.26 ± 0.02 b 0.30 ± 0.02 ab 0.33 ± 0.02 a 0.085 0.30 ± 0.05 c 0.33 ± 0.02 c 0.46 ± 0.01 b 0.54 ± 0.01 a 0.17 1.13 ± 0.04 d 1.38 ± 0.07 c 1.63 ± 0.13 b 1.93 ± 0.16 a 1.7 6.07 ± 0.03 d 8.23 ± 0.05 c 10.50 ± 0.28 b 12.75 ± 0.10 a 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s); T3—28℃/18℃, 55%/65%, 300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). 同行数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in the same row indicate significant difference between treatments (P<0.05). 表 4 不同环境条件和硅浓度下黄瓜被动吸收和总吸收及被动吸收占比
Table 4 Passive absorption and percentage of passive absorption in cumber at different environments and Si supply levels
处理
TreatmentsSi 0.085 mmol/L Si 0.17 mmol/L Si 1.7 mmol/L P
(mg/g)A
(mg/g)占比 (%)
PercentageP
(mg/g)A
(mg/g)占比 (%)
PercentageP
(mg/g)A
(mg/g)占比 (%)
PercentageT1 0.66 ± 0.06 d 1.67 ± 0.11 d 39.5 ± 1.0 d 1.35 ± 0.13 d 3.20 ± 0.13 d 42.1 ± 0.6 d 9.26 ± 0.53 d 17.97 ± 0.53 c 51.5 ± 1.0 d T2 0.81 ± 0.02 c 1.85 ± 0.02 c 42.9 ± 0.4 c 1.63 ± 0.12 c 3.59 ± 0.01 c 45.3 ± 0.3 c 10.95 ± 0.49 c 17.98 ± 0.71 c 60.9 ± 0.8 c T3 0.98 ± 0.07 b 2.13 ± 0.06 b 45.9 ± 0.4 b 1.87 ± 0.21 b 3.90 ± 0.23 b 48.0 ± 0.4 b 14.72 ± 0.59 b 21.69 ± 0.62 b 67.9 ± 2.0 b T4 1.22 ± 0.03 a 2.38 ± 0.05 a 51.3 ± 0.5 a 2.16 ± 0.22 a 4.16 ± 0.23 a 52.0 ± 0.4 a 17.76 ± 0.62 a 24.47 ± 0.89 a 72.6 ± 0.4 a 注(Note):T1—昼/夜温度 22℃/12℃、相对湿度 85%/95%、光照强度 300 μmol/(m2·s) Day/night temperature 22℃/12℃, relative humidity 85%/95%, light intensity 300 μmol/(m2·s); T2—22℃/12℃, 85%/95%, 600 μmol/(m2·s); T3—28℃/18℃, 55%/65%, 300 μmol/(m2·s); T4—28℃/18℃, 55%/65%, 600 μmol/(m2·s). P—通过蒸腾流计算的硅吸收量,代表被动吸收量 Silicon absorption calculated by transpiration streams, representing passive absorption; A—测量的硅吸收,代表总吸收量 Measured Si absorption, representing total absorption. -
[1] 李红丽. 嫁接对黄瓜果实品质影响的研究[D]. 山东泰安: 山东农业大学硕士学位论文, 2005. Li H L. Studies on the effect of graft on the quality of cucumber fruits[D]. Tai'an, Shandong: MS Thesis of Shandong Agricultural University, 2005.
[2] 大薮哲也, 施山纪男, 今田成雄, 等. 接ぎ木キュウリの光合成及び 14C同化产物の转流に及ぼすブル-ムレス台木の影响[J]. 园学杂, 1989, 58: 276–277. Oyabu T, Seyama N, Shigeo I, et al. The influence by bloomless rootstock on photosynthesis and 14C assimilate transportation in cucumber[J]. Japan. Soc. Hort. Sci, 1989, 58: 276–277.
[3] 张红梅, 金海军, 余纪柱,等. 不同南瓜砧木对嫁接黄瓜生长和果实品质的影响[J]. 内蒙古农业大学学报(自然科学版), 2007, 28(3): 177–181. Zhang H M, Jin H J, Yu J Z, et al. Effects of different pumpkin rootstocks on growth and fruit quality of grafting cucumber[J]. Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2007, 28(3): 177–181.
[4] Hayashi T, Suzuki T, Oosawa K. Correlation between occurrence of bloom on cucumber fruit and air temperature in a plastic film greenhouse[J]. Acta Horticulturae, 2002, 13(4): 280–282.
[5] Samuels A L, Glass A D M, Ehret D L, et al. The effects of silicon supplementation on cucumber fruit: changes in surface characteristics[J]. Annals of Botany, 1993, 72(5):433–440. DOI: 10.1006/anbo.1993.1129
[6] Seki M, Hotta Y. Effect of bloomless stock cultivar on the growth and mineral uptake of cucumber (Cucumis sativus) plants[J]. Research Bulletin of the Aichi-ken Agricultural Research Center, 1997.
[7] 刘青, 魏珉, 沈琼,等. 不同砧木对嫁接黄瓜蜡粉形成及硅吸收分配的影响[J]. 园艺学报, 2012, 39(5): 897–904. Liu Q, Wei M, Shen Q, et al. Effects of different rootstocks on bloom formation and absorption and distribution of silicon in grafted cucumber[J]. Acta Horticulturae Sinica, 2012, 39(5): 897–904.
[8] 沈琼, 崔健, 申太荣,等. 嫁接黄瓜果实表面蜡粉形成与砧木的相关性及其硅吸收分配特性[J]. 植物营养与肥料学报, 2014, 20(1): 254–258. Shen Q, Cui J, Shen T R, et al. Correlation between bloom formation on fruit surface of grafted cucumber and rootstocks and absorption and distribution of silicon[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(1): 254–258.
[9] Epstein E. Silicon[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 641–664..
[10] Takahashi E, Ma J F, Miyake Y. The possibility of silicon as an essential element for higher plants[J]. comments on Agricultural and Food Chemistry, 1990, 2(2): 99–122.
[11] 李晓艳, 孙立, 吴良欢. 不同吸硅型植物各器官硅素及氮、磷、钾素分布特征[J]. 土壤通报, 2014, 45(1): 193–198. Li X Y, Sun L, Wu L H. The distribution of silicon, nitrogen, phosphorus and potassium in the organs of different silicon-absorbing plants[J]. Chinese Journal of Soil Science, 2014, 45(1):193–198.
[12] Mitani N, Ma J F. Uptake system of silicon in different plant species[J]. Journal of Experimental Botany, 2005, 56(414): 1255. DOI: 10.1093/jxb/eri121
[13] Liang Y, Si J, Römheld V. Silicon uptake and transport is an active process in Cucumis sativus[J]. New Phytologist, 2005, 167(3): 797–804. DOI: 10.1111/j.1469-8137.2005.01463.x
[14] Faisal S, Calliskristine L, Slot M, et al. Transpiration-dependent passive silica accumulation in cucumber (Cucumis sativus) under varying soil silicon availability[J]. Botany, 2012, 90(10): 1058–1064. DOI: 10.1139/b2012-072
[15] 范培培, 朱祝军, 于超, 等. 黄瓜中硅的生理功能及转运机制研究进展[J]. 植物生理学报, 2014(2):117–122. Fan P P, Zhu Z J, Yu C, et al. Progress in research of physiological function and transport mechanisms of silicon in cucumber[J]. Plant Physiology Journal, 2014, 50(2): 117–122.
[16] 李惠霞, 周婷, 刘岩,等. 不同番茄品种镁吸收特性比较[J]. 植物营养与肥料学报, 2018, 24(1): 187–194. Li H X, Zhou T, Liu, Y, et al. Comparison of magnesium uptake properties of three tomato cultivars[J]. Journal of P1ant Nutrition and Fertilizer, 2018, 24(1): 187–194.
[17] 华海霞, 梁永超, 娄运生,等. 水稻硅吸收动力学参数固定方法的研究[J]. 植物营养与肥料学报, 2006, 12(3):358–362. DOI: 10.3321/j.issn:1008-505X.2006.03.012 Hua H X, Liang Y C, Lou Y S, et al. Comparison of research methods for silicon uptake kinetics of rice[J]. P1ant Nutrition and Fertilizer Science, 2006, 12(3):358–362. DOI: 10.3321/j.issn:1008-505X.2006.03.012
[18] Vorm P D J V D. Dry ashing of plant material and dissolution of the ash in HF for the colorimetric determination of silicon[J]. Communications in Soil Science & Plant Analysis, 1987, 18(11):1181–1189.
[19] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. Li H S. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000.
[20] Liang Y C, Nikolic M, Bélanger R, et al. Silicon uptake and transport in plants: physiological and molecular aspects[A]. Liang Y C, Nikolic M, Bélanger R, et al. Silicon in agriculture[M]. Dordrecht: Springer, 2015.
[21] Rao G B, Susmitha P. Silicon uptake, transportation and accumulation in rice[J]. Pharmacognosy Journal , 2017, 6(6):290–293.
[22] Guntzer F, Keller C, Meunier J D. Benefits of plant silicon for crops: a review[J]. Agronomy for Sustainable Development, 2012, 32(1): 201–213. DOI: 10.1007/s13593-011-0039-8
[23] 张中典, 张大龙, 李建明, 等. 黄瓜气孔导度、水力导度的环境响应及其调控蒸腾效应[J]. 农业机械学报, 2016, 47(6):139–147. Zhang Z D, Zhang D L, Li J M, et al. Environmental response of stomatal and hydraulic conductances and their effects on regulating transpiration of cucumber[J]. Transactions of the Chinese Society for Agricultural Machinery 2016, 47(6):139–147.
[24] 张大龙, 宋小明, 杜清洁,等. 温室环境因子驱动甜瓜水分传输机理分析与模拟[J]. 农业机械学报, 2017, 48(2): 232–239. Zhang D L, Song X M, Du Q J, et al. Mechanism analysis and simulation of water transport driven by environmental factors for greenhouse muskmelon[J]. Transactions of the Chinese Society of Agricultural Machinery, 2017, 48(2): 232–239.
[25] 沈琼. 黄瓜果实表面蜡粉形成及其与硅吸收分配的关系研究[D]. 山东泰安: 山东农业大学硕士学位论文, 2013. Shen Q. Studies on bloom formation on fruit surface of cucumber and the relationship with absorption and distribution of silicon[D]. Tai′an, Shandong: MS Thesis of Shandong Agricultural University, 2011.
[26] 孟庆伟, 高辉远. 植物生理学[M]. 北京: 中国农业出版社, 2011. Meng Q W, Gao H Y. Plant physiology[M]. Beijing: China Agriculture Press, 2011.
[27] 王东旭. 硅转运相关基因CSiT-1和CSiT-2克隆表达与转化黄瓜研究[D]. 浙江临安: 浙江农林大学硕士学位论文, 2013. Wang D X. Cloning, expression and transformation of silicon transport gene CSiT-1 and CSiT-2 in cucumber[D]. Lin'an, Zhejiang: MS Thesis of Zhejiang A&F University, 2013.
-
期刊类型引用(9)
1. 苏亚飞,包文彬,李彦生,于镇华,刘晓冰. 农田土壤酸化:原理、危害及缓解措施. 土壤与作物. 2025(01): 1-14 .  百度学术
百度学术
2. 孙鹏洲,罗珠珠,李玲玲,牛伊宁,王晓菲,田建霞,刘家鹤. 黄土高原紫花苜蓿种植对土壤反硝化细菌群落的影响. 中国生态农业学报(中英文). 2023(01): 67-78 .  百度学术
百度学术
3. 晁韶良,郇环,周向同,刘媚. 包气带反硝化菌多样性和群落结构垂向分布规律与主控环境因子研究:以北京市潮白河冲洪积扇为例. 环境科学研究. 2023(07): 1354-1367 .  百度学术
百度学术
4. 刘耕苑,肖杰,高明霞,孙本华,张树兰,杨学云,冯浩,张彤勋. 长期施肥对土nirS型反硝化细菌的影响及其与N_2O排放的关系. 水土保持研究. 2022(02): 99-105 .  百度学术
百度学术
5. 李德文,季倩如,刘英,周文玲,吴嘉仪,赵雨森. 农田防护林根际与非根际土壤氮素形态特征. 森林工程. 2022(03): 8-15+25 .  百度学术
百度学术
6. 喻江,李彦生,谢志煌,高志颖,刘晓冰,于镇华. 不同施肥方式对东北旱田黑土nirK和nirS型反硝化细菌群落结构的影响及黑土保护建议. 自然资源学报. 2022(09): 2306-2318 .  百度学术
百度学术
7. 雷善钰,辜运富,张亚洁,叶田会,杨鹏,余伟,闫芳芳,张宗锦. 攀枝花干热河谷区不同海拔高度农田土壤nirS型反硝化细菌的群落结构分析. 土壤通报. 2022(06): 1368-1375 .  百度学术
百度学术
8. 李玉倩,马俊伟,高超,霍守亮,夏星辉. 青藏高原高寒湿地春夏两季根际与非根际土壤反硝化速率及nirS型反硝化细菌群落特征分析. 环境科学. 2021(10): 4959-4967 .  百度学术
百度学术
9. 宋延静,马兰,李俊林,单燕,王洁,赵玲玲,王向誉. 山东省盐渍化地区芦苇根际反硝化细菌群落结构研究. 山东农业科学. 2021(12): 137-142 .  百度学术
百度学术
其他类型引用(14)



 下载:
下载: