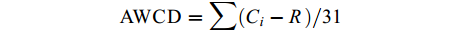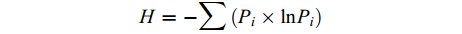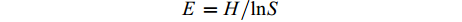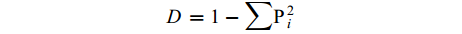Effect of biochar addition on soil microbial biomass and metabolic activities of carbon sources in Lou soil
-
摘要:目的
研究果树树干、枝条制成的生物炭添加4~5年后,其添加量对土微生物量及碳源代谢活性的影响,为生物炭改良土的合理应用提供数据支撑和理论依据。
方法基于陕西关中土的长期田间试验,采用氯仿熏蒸—浸提法及Biolog-ECO检测法,研究了生物炭不同添加量 (0、20、40、60、80 t/hm2) 下冬小麦不同生育期土壤微生物量C、N、P、C/N的动态变化及土壤微生物的碳源代谢活性。
结果当生物炭添加量为40~60 t/hm2时,显著提高了土壤微生物量碳;当生物炭添加量 ≥ 40 t/hm2时,显著提高了土壤微生物量C/N;添加生物炭对土壤微生物量N、P没有显著影响。当生物炭添加量为20 t/hm2时,显著增加了土壤微生物量碳的季节波动;当生物炭添加量为40~60 t/hm2时,显著增加了土壤微生物量C/N的季节波动;当生物炭添加量为20~60 t/hm2时,显著降低了土壤微生物量P的季节波动;添加生物炭对土壤微生物量N的季节波动没有显著影响。添加生物炭对土壤微生物碳源代谢活性没有显著影响,但高量生物炭的添加有降低土壤微生物整体代谢活性的趋势。当生物炭添加量为60 t/hm2时,显著降低了土壤丰富度指数,显著提高了均匀度指数;当生物炭添加量 ≥ 60 t/hm2时,显著降低了Shannon-Wiener指数、Simpson指数。添加生物炭对土壤微生物利用糖类、氨基酸类、多聚物类、多酚化合物类、多胺类碳源的利用率没有显著影响,但生物炭添加量为60 t/hm2时,土壤微生物显著降低了对羧酸类碳源的利用率;糖类、羧酸类、氨基酸类是土中微生物比较偏好、利用率较高的碳源。
结论生物炭添加4~5年后,在第7季作物冬小麦生育期内,其不同添加量对土壤微生物量及微生物功能多样性的影响依然有显著的差异。生物炭添加量为40 t/hm2时,可以显著提高土壤微生物量碳和C/N,显著降低土壤微生物量磷的季节波动;生物炭添加量大于40 t/hm2时,土壤微生物的整体代谢活性,表征土壤微生物功能多样性的丰富度指数、Shannon-Wiener指数、Simpson指数,土壤微生物对糖类、氨基酸类、多胺类碳源的利用率均呈现降低趋势。因此,生物炭添加量必须控制在合理的范围内,避免对土壤产生不良影响。
Abstract:ObjectivesThe residual effect of different biochar after 4 to 5 years’ application was investigated, in order to provide data and theory references for suitable use of biochar in Lou soil amendment.
MethodsA field experiment was carried out on Lou soil of Guanzhong Plain, Shaanxi Province. The tested biochar was made from trunk and branch of fruit trees, and was once added into soil in 5 levels (0, 20, 40, 60 and 80 t/hm2). Five years later, the soil microbial biomass C, N, P contents and the C/N ratio were analyzed; the microbial carbon metabolic activities were studied by the chloroform fumigation–extraction and biolog-ECO plates.
ResultsWhen the biochar addition was 40–60 t/hm2, the soil microbial biomass C increased significantly. When the biochar addition was above or equal to 40 t/hm2, the soil microbial biomass C/N ratio increased significantly. The biochar addition had no significant effect on soil microbial biomass N and P contents. When the biochar addition was 20 t/hm2, the seasonal fluctuation of soil microbial biomass C increased significantly. When the biochar addition was 40–60 t/hm2, the seasonal fluctuation of soil microbial biomass C/N increased significantly. When the biochar addition was 20–60 t/hm2, the seasonal fluctuation of soil microbial biomass P decreased significantly. The biochar addition did not influence the seasonal fluctuation of soil microbial biomass N significantly. The biochar addition had no significant effects on carbon source metabolic activities. However, the addition of high amount of biochar had a tendency to reduce the overall carbon source metabolic activities of soil microorganisms. When the biochar addition was 60 t/hm2, the richness index decreased significantly, while the evenness index increased significantly. When the biochar addition was above or equal to 60 t/hm2, Shannon-Wiener index, Simpson index decreased significantly. The biochar addition had no significant effects on the utilization rates of soil microorganisms to use C sources such as carbohydrates, amino acids, polymers, aromatic chemicals and amines. When the biochar addition was 60 t/hm2, the utilization rate of soil microorganisms using carboxylic acids decreased significantly. Carbohydrates, carboxylic acids and amino acids were the preferable carbon sources with higher carbon utilization efficiency for soil microorganisms.
ConclusionsThe biochar addition rate significantly affects the soil microbial biomass and microbial functional diversity even after 4 to 5 years’ application. When the biochar addition was 40 t/hm2, the soil microbial biomass C and C/N increased significantly, and there is no significant seasonal fluctuation in soil microbial biomass P. When the biochar addition was above 40 t/hm2, the overall carbon source metabolic activities of soil microorganisms, richness index, Shannon-Wiener index and Simpson index indicating soil microbial functional diversity, and the utilization rates of soil microorganisms to use C sources such as carbohydrates, amino acids, and amines shows a decreasing trend. Therefore, biochar application must be controlled within a reasonable range to avoid adverse effects on soil.
-
土壤微生物作为生物圈中不可缺少的活性部分,参与动植物残体降解、养分循环与平衡、土壤污染的生物修复等过程,能敏感地反映土壤生态系统发生的微小变化[1]。土壤微生物量是指土壤中体积小于5 × 103 μm3的生物总量[2] (活的植物体如植物根系除外),是反映土壤养分转化循环和能量流动的重要指标[3],而土壤微生物代谢活性一直是衡量土壤健康质量和生态系统稳定性的重要生物指标[4]。生物炭的添加会直接或间接影响土壤微生物的生长代谢,提高或降低土壤微生物量,改变土壤微生物的群落结构组成,从而影响土壤环境中微生物主导的生物地球化学循环[5],Zavalloni等[6]的短期试验表明,添加易变有机碳含量低的生物炭对土壤微生物量无显著影响;相反,张星等[7]的长期定位试验显示,添加生物炭显著提高了微生物量碳、氮。陈伟等[8]的盆栽试验发现,稻壳生物炭添加量分别为土重3%和6%时,均提高了供试褐土中微生物对碳源的利用能力;而武爱莲等[9]在褐土中施用0、5、10、30、60 g/kg玉米秸秆生物炭的盆栽试验结果显示,高量生物炭的添加影响了土壤微生物利用碳源的能力,导致其碳源代谢活性降低。
目前,关于生物炭对土壤微生物影响的报道多集中在生物炭对农田肥力相关菌群生长代谢影响的盆栽或短期田间试验上,对土壤微生物生态功能长期效应影响的研究还比较匮乏[5]。因此,本文通过长期田间试验,研究了生物炭添加4~5年后,其添加量对冬小麦不同生育期土壤微生物量的动态变化及对土壤微生物碳源代谢活性的影响,以期为生物炭在陕西关中地区的合理应用提供科学依据。
1. 材料与方法
1.1 试验区概况
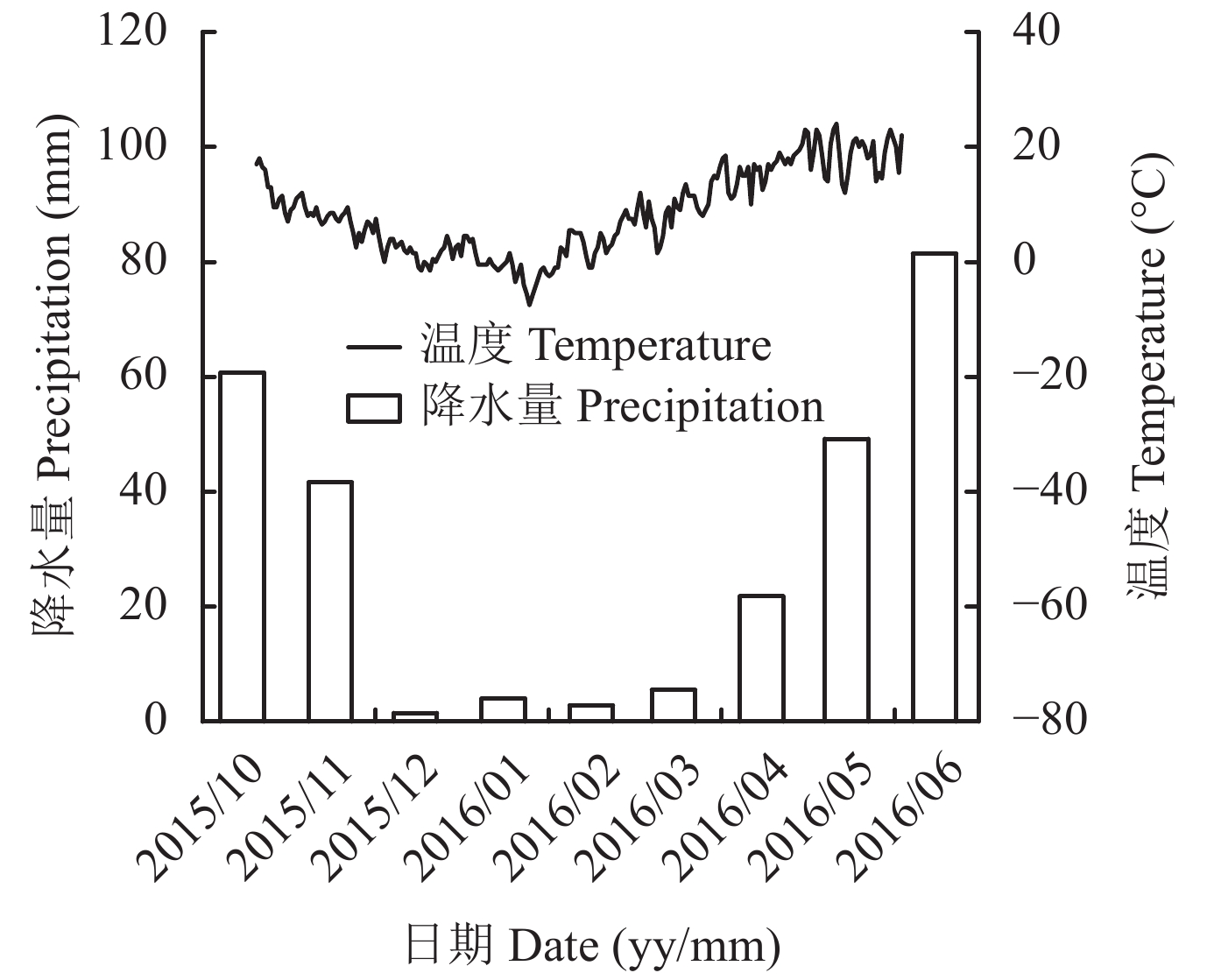
试验于2015年10月到2016年6月在陕西省杨凌示范区西北农林科技大学试验田 (34°16′N,108°04′E,海拔458.6 m) 进行,其基本理化性质为:有机质12.6 g/kg、全氮0.71 g/kg、全磷0.43 g/kg、全钾19.6 g/kg、硝态氮18.2 mg/kg、铵态氮15.9 mg/kg、速效磷12.4 mg/kg、速效钾193 mg/kg、pH (水土比2.5∶1) 7.3、容重1.30 g/cm3。试验区地势平坦,属于暖温带大陆性季风气候,年均气温11~13℃,年降水量500~700 mm,年均日照时数2196 h,无霜期210 d。试验区土壤类型为褐土类,土亚类,红油土属,黄土母质,系统分类为土垫旱耕人为土,属石灰性土壤。2015—2016年冬小麦生长季的温度和降水量如图1所示。
1.2 试验材料
供试生物炭是由废弃果树树干、枝条在450℃裂解炉中、限氧条件下裂解所得,由陕西亿鑫生物能源科技开发有限公司提供。基本理化性质为:C 72.38%、N 1.19%、O 23.81%、H 2.62%、灰分13.98%、硝态氮0.52 mg/kg、铵态氮1.86 mg/kg、易氧化有机碳73.59 g/kg、比表面积86.7 m2/g、pH (水土比10∶1) 10.43。
1.3 试验设计
本试验采用随机区组设计,根据前期室内模拟试验及前人研究文献中生物炭的不同添加量[10-11],共设置了生物炭添加量为0、20、40、60、80 t/hm2 的5个处理,代码依次为B0、B20、B40、B60、B80,每个处理3次重复,共15个小区,小区规格为1.35 m × 3.50 m,各个小区之间均设有0.5 m隔离保护带。于2012年4月27日田间试验开始前,将供试生物炭磨细过1 mm筛后一次性撒施于表层土壤,深翻使之与耕层土壤充分混匀,之后不再施用生物炭,到2015年10月,连续种植了7季作物,分别为玉米、小麦、玉米、小麦、玉米、辣椒、小麦。每季作物所需的氮、磷、钾肥均作为基肥,于播种前施入,依据当地常规进行除草、冬灌、防控病虫等田间管理,具体施肥量见表1。
表 1 2012—2015年7季作物品种及施肥量Table 1. Fertilizer application rates and cultivars for different crop growing seasons during 2012 to 2015播种时间 (yy-mm)
Sowing time供试作物
Crop type品种
Cultivar尿素 (N, kg/hm2)
Urea磷酸二铵 (P2O5, kg/hm2)
Diammonium phosphate硫酸钾 (K2O, kg/hm2)
Potassium sulphate2012–04 春玉米Spring corn 正大12 Zhengda 12 225 180 150 2012–10 冬小麦Winter wheat 小偃22 Xiaoyan 22 225 180 150 2013–06 夏玉米Summer corn 正大12 Zhengda 12 225 180 150 2013–10 冬小麦Winter wheat 小偃22 Xiaoyan 22 225 180 150 2014–06 夏玉米Summer corn 正大12 Zhengda 12 225 180 150 2015–04 辣椒Chilli 黑风Heifeng 0 0 0 2015–10 冬小麦Winter wheat 西农509 Xinong 509 225 180 150 1.4 样品的采集与分析
土壤样品于2015—2016年度冬小麦的不同生育期 (分蘖期、越冬期、返青起身期、拔节孕穗期、灌浆成熟期),采用对角线5点法采集0—20 cm土层的土壤。随后将新鲜土壤样品过2 mm筛后混合均匀,放入无菌袋中,于4℃冰箱中保存,测定其微生物量及微生物功能多样性。
土壤微生物量碳、氮采用氯仿熏蒸—0.5 mol/L K2SO4直接浸提法测定[12-13]。首先将土壤样品在25℃下密封培养7天,然后称取6份预处理的新鲜土样7.5 g放入铝盒中,将其中3份置于真空干燥器 (底部放置有3个烧杯,其中一杯稀NaOH、一杯水和一杯去除乙醇的氯仿) 中,抽真空时,保持氯仿剧烈沸腾3~5 min,然后将真空干燥器移置在黑暗条件中熏蒸土壤24 h,熏蒸结束后,打开真空干燥器阀门,取出氯仿,在通风橱中使土壤中的氯仿完全散尽。将熏蒸好的土壤转移到100 mL离心管中,加入0.5 mol/L K2SO4浸提液 (水土质量比为4∶1)。另外3份未熏蒸土样操作相同,同时做空白试验。浸提液中的C采用TOC-VCHP有机碳分析仪测定,土壤微生物量N采用连续流动分析仪测定。
土壤微生物量磷采用氯仿熏蒸—0.5 mol/L NaHCO3浸提法测定。浸提液中的微生物量P采用钼锑抗比色法测定[14-16]。
土壤微生物功能多样性采用Biolog-Eco检测法[17]测定,取相当于5.0 g风干土壤样品的新鲜土壤样品加入装有45 mL无菌生理盐水 (0.85%) 的三角瓶中,用无菌封口膜封口后在摇床 (转速160 r/min) 上振荡30 min,得到土壤样品的微生物悬浮液。静置片刻后吸取其上清液,在超净工作台上,采用10倍稀释法,用无菌生理盐水 (0.85%) 稀释浓度至10–3倍,随后用8通道加样器将稀释1000倍的土壤微生物悬浮液接种于Biolog-ECO微平板 (ECO Micro Plate,美国Marix Technologies Corporation) 上,每孔150 μL。将接种后的Biolog-ECO微平板放入28℃生化培养箱中连续培养240 h,每个土壤样品均做3次重复,每24 h用Biolog微生物自动读数装置读取Biolog-ECO微平板在590 nm波长下的吸光值。
1.5 试验数据处理
土壤微生物量碳 (MBC)、氮 (MBN)、磷 (MBP) 通过测定熏蒸、不熏蒸土壤浸提液中碳、氮、磷的增加量来计算,公式[18]如下:
MBC = (熏蒸土壤有机碳 – 未熏蒸土壤有机碳)/0.45
MBN = (熏蒸土壤微生物量氮 – 未熏蒸土壤微生物量氮)/0.25
MBP = (熏蒸土壤浸提的磷量 – 未熏蒸土壤浸提的磷量)/(0.4 × R)
式中:0.45为浸提液中的有机碳增量换算成MBC的转化系数 (kEc);0.25为微生物体氮的矿化系数,即矿化出来的微生物体氮仅为微生物体总氮的0.25倍;0.4为浸提液中MBP占总MBP的比例;R为加入无机磷的回收率,R = (土壤加入K2HPO4溶液后再浸提所得的磷量–未熏蒸土壤浸提的磷量)/25 × 100%,其中,25为浸提前加入的磷量。
土壤微生物代谢活性采用反应孔颜色的平均变化率 (average well color development,AWCD) 表示,代表可培养微生物对不同底物 (碳源) 的利用能力,计算公式[19]如下:
AWCD=∑(Ci−R)/31 式中:AWCD为反应孔颜色的平均变化率;Ci为各反应孔在590 nm下的吸光值;R为Biolog-ECO微平板对照孔A1的吸光值;Ci – R < 0的反应孔,计算中默认为零,即Ci – R ≥ 0。
土壤微生物群落丰富度指数 (richness index,S) 采用反应孔 (吸光值 > 0.25,则代表该孔的C源被利用,该孔为反应孔) 的数目表示[20]。
土壤微生物群落Shannon–Wiener指数 (H),代表微生物群落物种和个体分布的均匀程度。
H=−∑(Pi×lnPi) 式中:H为土壤微生物群落Shannon–Wiener指数;Pi为第i个生物量占总生物量的比率,其中Pi = (Ci – R)/
∑ (Ci – R),表示C源孔与对照孔A1的吸光值之差与整板总差的比值。土壤微生物群落均匀度指数 (evenness index,E) 采用微生物群落Shannon–Wiener指数与生物量总量对数的比值表示[21]。
E=H/lnS 式中:E为土壤微生物群落均匀度指数;H为土壤微生物群落Shannon–Wiener指数;S为生物量总量,即丰富度指数。
土壤微生物群落Simpson指数 (D),又称为优势度指数,用于评估某些最常见种的优势度[22]。
D=1−∑P2i 式中:D为土壤微生物群落Simpson指数;Pi为第i个生物量占总生物量的比率。
主成分分析 (principal component analysis,PCA) 是利用降维的思想,在损失较少信息的前提下,将多个变量转化为少数几个综合变量的方法,采用土壤培养168 h吸光值的平均数进行微生物功能多样性的主成分分析。数据矩阵包括20行、31列,分别代表试验设计中5个处理的4个生育期、Biolog-Eco微平板上的31种碳源。
试验数据采用Microsoft Excel 2013、SPSS 20.0 (采用Duncan多重比较检验法分析不同处理之间各指标的显著性差异,显著性水平设定为α = 0.05) 整理分析,图形采用Origin 9.0绘制。
2. 结果与分析
2.1 不同生育期土壤微生物量碳的动态变化
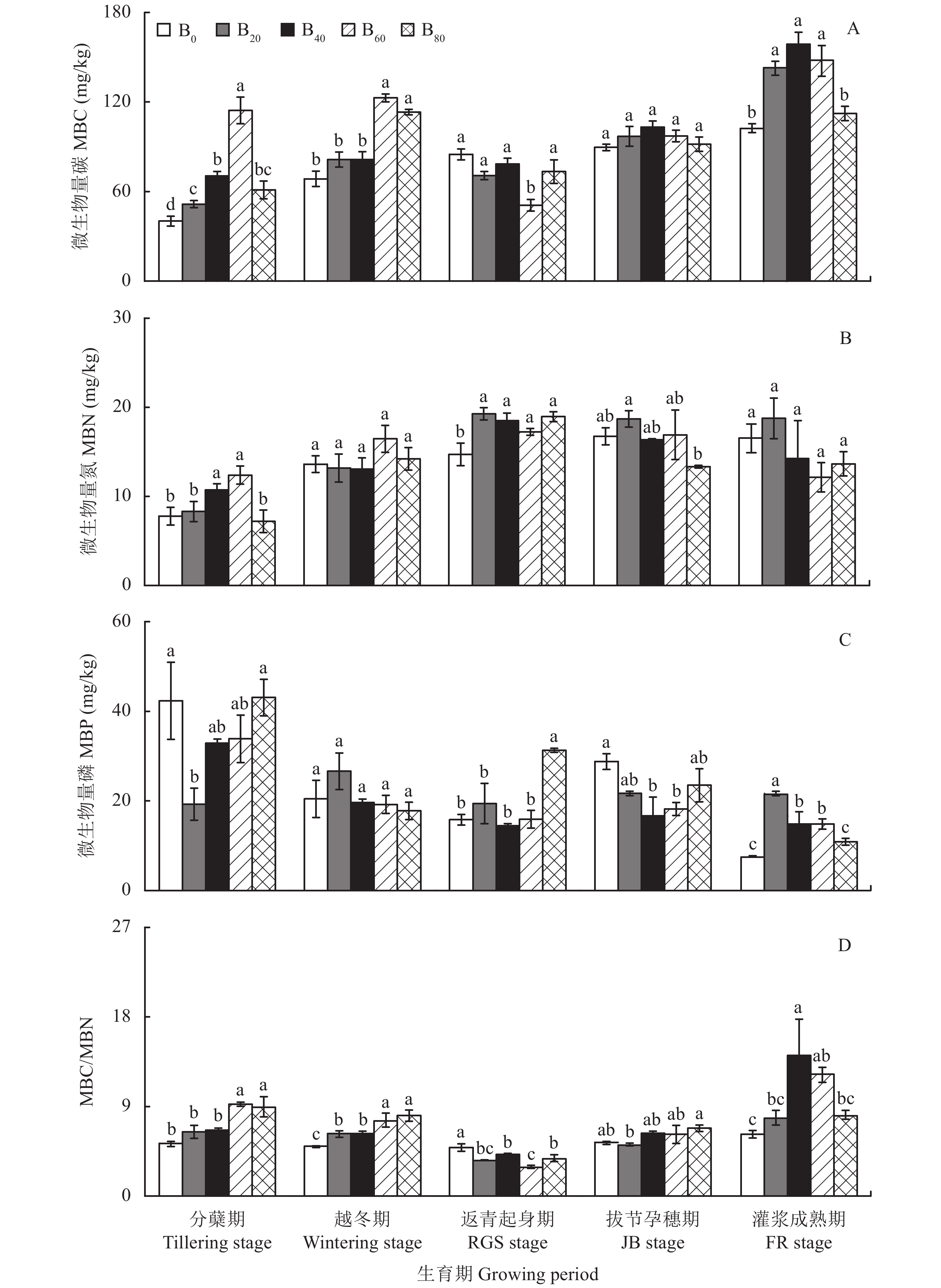
图2-A显示,冬小麦整个生育期,B20、B40、B60、B80处理的MBC变化趋势基本一致,均表现为上升—下降—上升的规律,具有明显的季节性;B0处理则一直呈现上升趋势。
与B0处理相比,分蘖期B20、B40、B60、B80处理的MBC分别增加了28.2%、75.4%、184.3%、51.8%,均达到显著水平;越冬期B20、B40、B60、B80处理的MBC分别增加了18.9%、19.0%、79.3%、65.4%,其中B60、B80与B0处理的差异达到显著水平;返青起身期B20、B40、B60、B80处理的MBC分别降低了16.8%、7.50%、40.1%、13.6%,其中仅B60与B0的差异达到显著水平;拔节孕穗期B20、B40、B60、B80处理的MBC分别增加了8.25%、15.3%、8.58%、2.35%,不同处理间的差异均未达到显著水平;灌浆成熟期B20、B40、B60、B80处理的MBC分别增加了40.5%、55.9%、44.3%、8.70%,其中B20、B40、B60与B0处理的差异达到显著水平。
随着生物炭添加量的增加,分蘖期、越冬期、拔节孕穗期、灌浆成熟期MBC的增幅呈现先上升后下降的单峰曲线,分蘖期、越冬期的MBC均在生物炭添加量为60 t/hm2时达到峰值;拔节孕穗期、灌浆成熟期的MBC均在生物炭添加量为40 t/hm2时达到峰值;返青起身期的MBC在生物炭添加量为60 t/hm2时降到最低,其降幅没有明显的变化规律。
B20、B40、B60、B80处理的MBC在冬小麦整个生育期的平均值与B0处理相比,分别增加了15.2%、27.9%、38.2%、16.9%,当生物炭添加量为40~60 t/hm2时达到显著水平,且增幅随添加量的增加呈现先上升后下降的变化趋势,说明添加生物炭有助于提高MBC,但添加量超过阈值后,效果反而下降。
![]() 图 2 不同生育期土壤微生物量碳、氮、磷、碳/氮的动态变化[注(Note):RGS—Returning green and setting;JB—Jointing and booting;FR—Filling and ripening;B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理 B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2. 柱上不同小写字母表示在同一生育期该指标不同处理间在0.05显著水平差异显著Different lowercase letters above the bars mean significant differences among treatments at the same growth period (P < 0.05).]Figure 2. Dynamic changes of soil microbial biomass carbon, nitrogen, phosphorus and carbon/nitrogen ratio at different growth periods of winter wheat
图 2 不同生育期土壤微生物量碳、氮、磷、碳/氮的动态变化[注(Note):RGS—Returning green and setting;JB—Jointing and booting;FR—Filling and ripening;B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理 B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2. 柱上不同小写字母表示在同一生育期该指标不同处理间在0.05显著水平差异显著Different lowercase letters above the bars mean significant differences among treatments at the same growth period (P < 0.05).]Figure 2. Dynamic changes of soil microbial biomass carbon, nitrogen, phosphorus and carbon/nitrogen ratio at different growth periods of winter wheat2.2 不同生育期土壤微生物量氮的动态变化
冬小麦整个生育期,B0、B40、B60处理的MBN变化趋势基本一致,均表现为先上升后下降的单峰曲线;B20、B80处理则呈现上升—下降—上升的变化趋势。B20、B40、B60、B80处理的MBN均在返青起身期达到峰值,与B0处理相比,均达到显著水平;B0处理则在拔节孕穗期达到峰值。越冬期、拔节孕穗期、灌浆成熟期B20、B40、B60、B80处理的MBN与B0处理的差异均未达到显著水平,分蘖期仅B40、B60处理的MBN与B0处理的差异达到了显著水平 (图2-B)。
与B0处理相比,B20、B40、B60处理的MBN在冬小麦整个生育期的平均值分别增加了12.7%、5.23%、8.43%,B80处理则减少了2.93%,均未达到显著水平,说明MBN对生物炭的添加并不敏感,生物炭的添加量过高易产生反作用,这可能是因为生物炭主要属于稳定的碳源,添加生物炭4~5年后,不能给土壤微生物提供较多的氮源[23]或生物炭中的惰性碳固持了土壤氮素,而高量生物炭的添加又会引起作物根系与土壤微生物对养分吸收竞争的激化,从而导致MBN降低,这与Zhang等[24]在华北平原连续四年施用生物炭的田间试验结果相似。
2.3 不同生育期土壤微生物量磷的动态变化
图2-C表明,B0、B40、B60、B80处理的MBP随不同生育期的变化均表现为下降–上升–下降的趋势,最高值均出现在分蘖期,与B0处理的差异均未达到显著水平;B20处理则没有明显的变化规律,最高值出现在越冬期,与B0处理的差异也未达到显著水平。
与B0处理相比,返青起身期B20、B60、B80处理的MBP分别增加了23.1%、0.63%、98.4%,B40降低了8.63%,其中仅B80与B0处理的差异达到显著水平;拔节孕穗期B20、B40、B60、B80处理的MBP分别降低了24.7%、42.1%、36.8%、18.4%,其中B40、B60与B0处理的差异均达到显著水平;灌浆成熟期B20、B40、B60、B80处理的MBP分别增加了185.4%、96.2%、95.1%、42.6%,其中B20、B40、B60与B0处理的差异均达到显著水平。
随着生物炭添加量的增加,土壤MBP在冬小麦整个生育期的平均值呈现先下降后上升的变化趋势,与B0处理相比,B20、B40、B60处理的MBP分别减少了5.57%、14.4%、11.4%,即当生物炭添加量为40 t/hm2时,降到最低;B80处理则增加了10.0%,不同处理间均未达到显著水平,说明添加生物炭后,随着作物根系[25]与土壤微生物竞争的激化,有效磷被耗竭时,微生物磷被迫释放出来,从而降低了MBP,当添加量为80 t/hm2时,MBP反而增加的原因可能是此时氮素的缺乏限制了作物根系与土壤微生物的竞争,保留了前期固持的MBP。
2.4 不同生育期土壤微生物量碳氮比的动态变化
图2-D显示,B20、B40、B60、B80处理的MBC/MBN随不同生育期的变化均表现为先下降后上升的趋势,在返青起身期降到最低,B0基本没有变化,始终维持在5.02~6.26之间。
与B0处理相比,分蘖期B20、B40、B60、B80处理的MBC/MBN分别增加了22.5%、25.4%、75.2%、69.8%,其中B60、B80与B0处理的差异达到显著水平;越冬期B20、B40、B60、B80处理的MBC/MBN分别增加了25.6%、25.3%、52.1%、61.5%,与B0处理的差异均达到显著水平;返青起身期B20、B40、B60、B80处理的MBC/MBN分别降低了37.3%、27.4%、49.8%、34.2%,与B0处理的差异均达到显著水平;拔节孕穗期B40、B60、B80处理的MBC/MBN分别增加了17.3%、15.2%、27.8%,而B20处理的MBC/MBN则降低了3.88%,不同处理间的差异均未达到显著水平;灌浆成熟期B20、B40、B60、B80处理的MBC/MBN分别增加了25.9%、126%、95.9%、30.9%,其中B40、B60与B0处理的差异达到显著水平。
随着生物炭添加量的增加,分蘖期的MBC/MBN在生物炭添加量为60 t/hm2时达到峰值,灌浆成熟期的MBC/MBN则在生物炭添加量为40 t/hm2时达到峰值,其增幅均呈现先上升后下降的单峰曲线;越冬期、拔节孕穗期的MBC/MBN均在生物炭添加量为80 t/hm2时达到峰值,其增幅呈现先下降后上升的变化趋势;返青起身期的MBC/MBN在生物炭添加量为60 t/hm2时降到最低,其降幅没有明显的变化规律。
B20、B40、B60、B80处理在冬小麦整个生育期MBC/MBN的平均值与B0处理相比,分别增加了3.75%、23.7%、25.1%、25.5%,当生物炭添加量 ≥ 40 t/hm2时,达到显著水平,说明生物炭的添加有助于提高MBC/MBN。
2.5 MBC、MBN、MBP及MBC/MBN的季节变异程度
由表2可知,冬小麦整个生育期,土壤微生物量表现出明显的季节波动,与B0处理相比,当生物炭添加量为20 t/hm2时,显著增加了MBC的季节波动,添加量为40~60 t/hm2时,显著增加了MBC/MBN的季节波动,添加量为20~60 t/hm2时,显著降低了MBP的季节波动,而添加生物炭对MBN的季节波动没有显著影响,表明添加生物炭可以增加或减少土壤微生物量的季节变化程度,降低或提高土壤环境的稳定性,这与其添加量息息相关。
表 2 不同处理下土壤微生物量的变异系数 (%)Table 2. Variation coefficients of soil microbial biomass in different treatments处理Treatment MBC MBN MBP MBC/MBN B0 31.29 bc 27.12 ab 58.06 a 8.93 b B20 39.35 a 32.26 a 21.60 c 26.45 ab B40 36.45 ab 29.22 a 42.90 b 46.92 a B60 34.14 ab 20.43 b 37.27 b 46.28 a B80 26.13 c 32.64 a 50.72 ab 28.63 ab 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;different lowercase letters within the same column indicate significant differences among treatments at 0.05 level. 2.6 不同生育期土壤微生物碳源代谢活性的动态分析
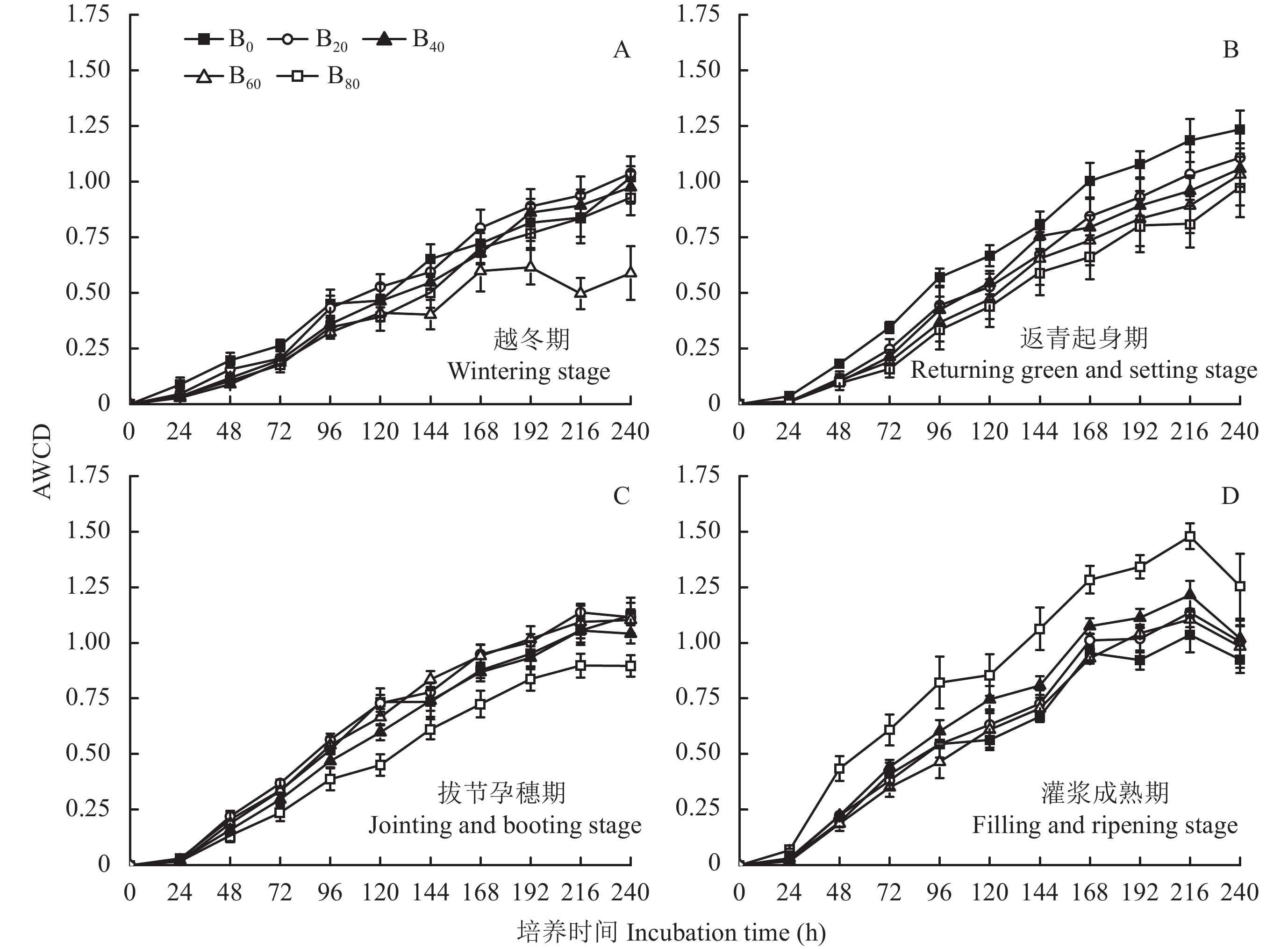
随着培养时间的延长,各个生育期土壤微生物的AWCD值逐渐上升,表明其碳源代谢活性逐渐增加,24 h内各处理的AWCD值无明显变化,24 h后快速上升,直至168 h后变化基本趋于平缓,表明土壤微生物生长减慢且步入了稳定期 (图3)。因此,可以确定培养时间168 h是所研究土壤微生物生长对数期和稳定期的临界值[26],因此,采用此时的AWCD值进行土壤微生物碳源代谢活性分析。
与B0处理相比,越冬期B20处理增加了9.62%,B40、B60、B80处理则分别减小了6.20%、17.2%、2.95%,差异均未达到显著水平 (图3-A);返青起身期B20、B40、B60、B80处理分别减小了15.9%、20.8%、26.6%、34.1%,其中B40、B60、B80与B0处理的差异均达到显著水平 (图3-B);拔节孕穗期B20、B60处理分别增加了8.23%、7.37%,而B40、B80处理分别减小了0.92%、20.9%,其中B80与B0的差异达到显著水平 (图3-C);灌浆成熟期B20、B40、B80处理分别增加了5.94%、12.6%、34.5%,而B60处理则减小了2.47%,其中B60、B80与B0处理的差异达到显著水平 (图3-D)。
不同生育期土壤培养168 h时,随着生物炭添加量的增加,土壤微生物AWCD的平均值呈现增加–降低–增加的变化趋势,但不同处理间没有显著差异。当生物炭添加量为20 t/hm2时,土壤微生物的AWCD值最高,而生物炭添加量 ≥ 40 t/hm2时,土壤微生物的AWCD值均低于B0处理,表明添加生物炭有助于提高土壤微生物的碳源代谢活性,但要严格控制其添加量,高量生物炭的添加有降低土壤微生物整体代谢活性的趋势。
2.7 土壤微生物功能多样性指数分析
采用不同生育期的土壤培养168 h吸光值的平均值进行土壤微生物功能多样性指数的计算(表3)。表3表明,随着生物炭添加量的增加,土壤丰富度指数、Shannon–Wiener指数、Simpson指数均呈现先下降后上升的变化趋势,均在生物炭添加量为0 t/hm2时最高,60 t/hm2时降到最低,表明生物炭的添加降低了土壤微生物群落的复杂程度;土壤均匀度指数则呈现先上升后下降的变化趋势,在生物炭添加量为60 t/hm2时升到最高,0 t/hm2时最低,表明生物炭的添加增加了土壤微生物群落物种分布的均匀程度。当生物炭添加量为60 t/hm2时,显著降低了土壤丰富度指数,显著提高了均匀度指数;当生物炭添加量 ≥ 60 t/hm2时,显著降低了Shannon–Wiener指数、Simpson指数。
表 3 土壤微生物功能多样性指数Table 3. Functional diversity indices of soil microbial community处理
Treatment丰富度指数
Richness indexShannon-Wiener指数
Shannon-Wiener index均匀度指数
Evenness indexSimpson指数
Simpson indexB0 22.71 ± 2.96 a 3.07 ± 0.11 a 0.99 ± 0.02 b 0.95 ± 0.01 a B20 22.04 ± 3.44 a 3.04 ± 0.13 ab 0.99 ± 0.02 ab 0.95 ± 0.01 ab B40 21.67 ± 3.23 ab 3.03 ± 0.12 ab 0.99 ± 0.02 ab 0.94 ± 0.01 ab B60 20.33 ± 3.80 b 2.98 ± 0.17 b 1.00 ± 0.02 a 0.94 ± 0.01 b B80 21.25 ± 4.53 ab 3.00 ± 0.18 b 0.99 ± 0.02 ab 0.94 ± 0.01 b 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;表中数值为平均值 ± 标准差;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;values in the table are mean ± SD;different lowercase letters in a column indicate significant differences among treatments at 0.05 level. 2.8 土壤微生物的碳源代谢类型分析
根据Biolog-ECO微平板上碳源官能团的不同将其分为6大类:其中糖类10种、氨基酸类6种、羧酸类7种、多聚物类4种、多酚化合物类2种、多胺类2种[27]。通过对6大类碳源吸光值的计算,可以明确土壤微生物对不同碳源的利用率。采用不同生育期的土壤培养168 h吸光值的平均值进行土壤微生物碳源代谢类型分析。
由表4可知,B0、B20、B40、B80处理的土壤微生物对六大类碳源的利用率由大到小依次为氨基酸类 > 糖类 > 羧酸类 > 多聚物类 > 多胺类 > 多酚化合物类;而B60的土壤微生物对六大类碳源的利用率由大到小则为氨基酸类 > 糖类 > 多聚物类 > 羧酸类 > 多胺类 > 多酚化合物类,表明氨基酸类、糖类是土中微生物利用率较高的碳源,这与本课题组前期的研究结果[28]相同。
表 4 土壤微生物对不同碳源的利用率Table 4. Use efficiencies of different carbon sources by soil microbial community处理
Treatment氨基酸类
Amino acid糖类
Carbohydrate羧酸类
Carboxylic acid多聚物类
Polymer多酚化合物类
Aromatic chemical多胺类
AmineB0 1.14 ± 0.25 a 0.98 ± 0.18 a 0.85 ± 0.23 a 0.71 ± 0.22 a 0.42 ± 0.20 a 0.63 ± 0.33 a B20 1.13 ± 0.30 a 1.03 ± 0.17 a 0.87 ± 0.25 a 0.66 ± 0.23 a 0.44 ± 0.29 a 0.60 ± 0.44 a B40 1.14 ± 0.30 a 0.96 ± 0.22 a 0.77 ± 0.27 ab 0.66 ± 0.22 a 0.37 ± 0.29 a 0.63 ± 0.37 a B60 1.07 ± 0.33 a 0.92 ± 0.24 a 0.70 ± 0.25 b 0.71 ± 0.28 a 0.29 ± 0.22 a 0.48 ± 0.46 a B80 1.04 ± 0.44 a 0.95 ± 0.32 a 0.81 ± 0.39 ab 0.71 ± 0.28 a 0.39 ± 0.39 a 0.53 ± 0.48 a 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;表中数值为平均值 ± 标准差;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;values in the table are mean ± SD;different lowercase letters in a column indicate significant differences among treatments at 0.05 level. 添加生物炭对土壤微生物利用糖类、氨基酸类、多聚物类、多酚化合物类、多胺类碳源的利用率没有显著影响,当生物炭添加量为60 t/hm2时,土壤微生物显著降低了对羧酸类碳源的利用率,说明外源生物炭的添加可以改变土壤微生物的碳源代谢类型。
2.9 土壤微生物功能多样性主成分分析
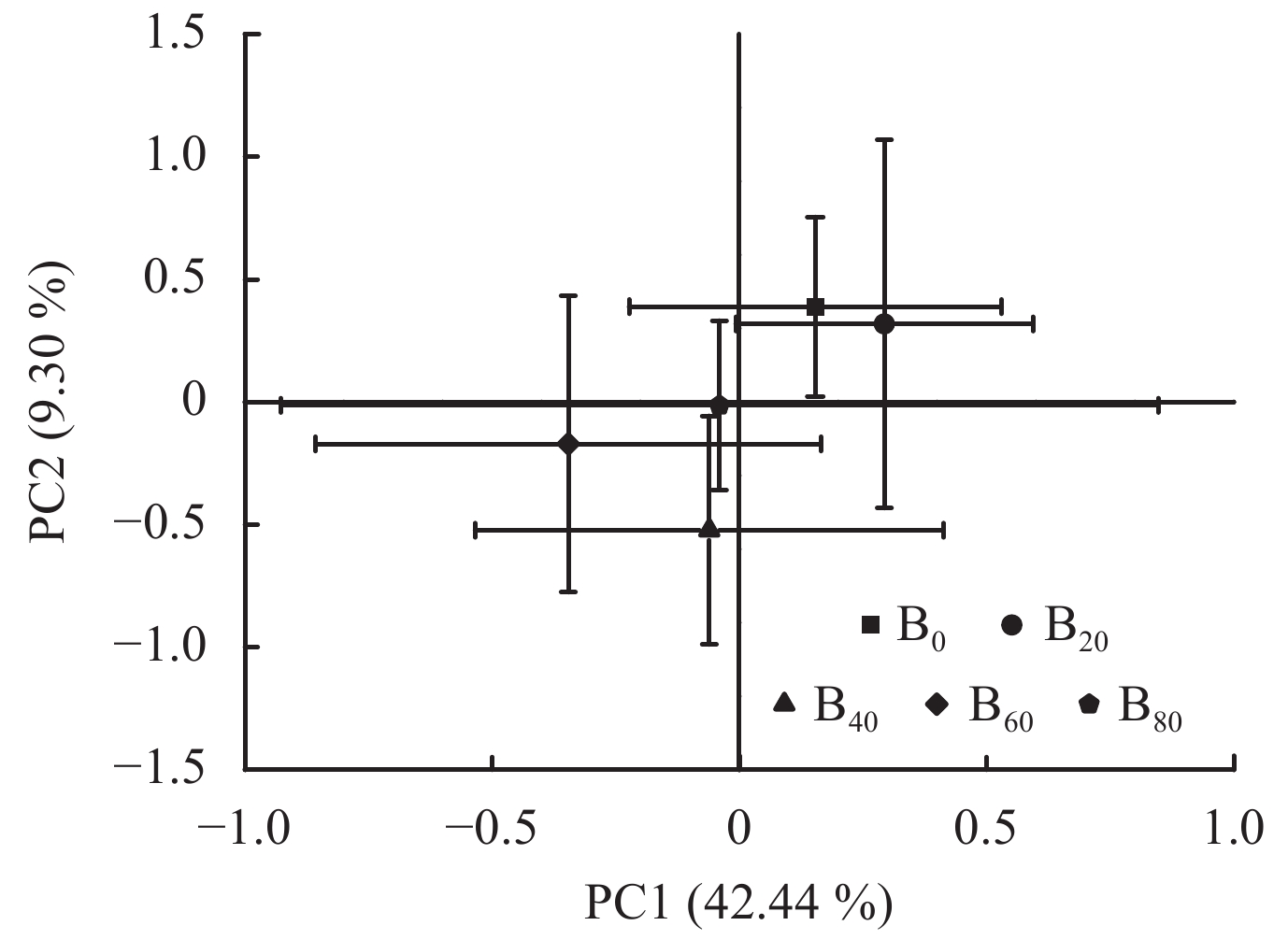
对土壤微生物碳源代谢情况进行主成分分析,提取主成分相对应特征值大于1的前8个主成分,累积贡献率为84.9%。其中第1主成分 (PC1) 的特征根和贡献率分别为13.2和42.4%,第2主成分 (PC2) 的特征根和贡献率分别为2.88和9.30%,第3~8主成分的特征根和贡献率较小,分别为1.29~2.44和4.16%~7.87%,其中对PC1贡献较大的碳源有14种,分别为糖类4种 (D,L–α–磷酸甘油、D–纤维二糖、N–乙酰–D葡萄糖氨、D–甘露醇)、羧酸类4种 (D–苹果酸、衣康酸、γ–羟丁酸、L–苯丙氨酸)、氨基酸类2种 (L–精氨酸、L–天门冬酰胺)、多胺类2种 (苯乙胺、腐胺)、多酚化合物类1种 (2–羟基苯甲酸)、多聚物类1种 (吐温40),对PC2贡献较大的碳源有2种,分别为多聚物类1种 (肝糖)、羧酸类1种 (丙酮酸甲酯),主要C源的利用类型为糖类、羧酸类、氨基酸类,表明糖类、羧酸类、氨基酸类碳源是土中微生物比较偏好的碳源,这与土壤微生物的碳源代谢类型分析结果相似 (表5)。
表 5 主要碳源与第一、第二主成分 (PC1和PC2) 的相关系数 (r)Table 5. Correlation coefficient r of main carbon sources with the 1st and the 2nd principle components (PC1 and PC2)PC1 r PC1 r PC2 r 4-羟基苯甲酸p-Hydroxybenzoic acid 0.877 N-乙酰-D葡萄糖氨N-acetyl-D-glucosamine 0.758 肝糖Glycogen 0.754 D,L-α-磷酸甘油D,L-α-glycerophosphate 0.831 衣康酸Itaconic acid 0.757 丙酮酸甲酯Methyl pyruvate 0.661 D-纤维二糖D-(+)-Cellobiose 0.830 腐胺Putrescine 0.740 L-精氨酸L(+)-Arginine 0.826 γ-羟丁酸γ-hydroxybutyric acid 0.715 L-天门冬酰胺L-Aspartic acid 4-amide 0.797 D-甘露醇D-Mannitol 0.711 D-苹果酸D-Malic acid 0.782 吐温40 Tween 40 0.698 苯乙胺Phenylethylamine 0.760 L-苯丙氨酸L-Phenylalanine 0.688 选取前两个主成分进行绘图,以PC1为横坐标 (x轴),PC2为纵坐标 (y轴),将不同处理在2个主成分上的得分值为坐标绘制而成土壤微生物功能多样性的主成分分析图。
PC1、PC2轴将不同处理分为2类,B0、B20分布在第一象限,B40、B60、B80分布在第三象限,说明B0和B20处理,B40、B60、B80处理的土壤微生物C源代谢模式或功能具有相似性,这也揭示了生物炭的不同添加量对土壤微生物群落多样性具有不同的生态效应 (图4)。
3. 讨论
3.1 生物炭对土壤微生物量的影响
研究结果表明,添加生物炭对土壤微生物量C、N有促进作用,其原因有以下两点:1) 生物炭对土壤理化特性的改善[28-30]间接影响了土壤微生物的生长环境,提高了土壤微生物量C、N的含量。2) 添加生物炭增加了冬小麦根系总根长和总表面积[25],其还田部分为土壤微生物生长提供了丰富的营养物质,增强了土壤微生物量C、N的含量。返青起身期天气逐渐回暖,土壤微生物活动增强,但生物炭的添加延缓了土壤的增温速度[30],因此,返青起身期B20、B40、B60、B80处理的微生物量碳均低于B0;但添加生物炭后,土壤微生物量氮的峰值提前,均集中于返青起身期,这可能是由于土壤氮素主要集中在耕层,其中93.0%~97.0%以有机氮的形式存在[31],此时土壤微生物因回温缓慢活性下降导致矿化速度减慢,因此,返青起身期B20、B40、B60、B80处理的微生物量氮均高于B0处理。
由于种植冬小麦前施入了磷肥,土壤有效磷随之增加,土壤微生物与作物根系并未形成竞争关系,更多的无机磷被同化结合到土壤微生物体内[31],因此,B0、B40、B60、B80处理的微生物量磷最高值出现在分蘖期;而B20处理的微生物量磷最高值出现在越冬期,可能是因为B20处理土温适宜、代谢弱,土壤微生物能在较低能量供给下生存,从而固持了较多的土壤微生物量磷。
土壤微生物量碳氮比 (C/N) 可表征微生物群落的结构特征[23],前人研究结果表明,细菌的微生物量C/N的范围为3~6,而真菌的范围则在7~12[31-34]。当添加量 ≥ 40 t/hm2时,土壤微生物量C/N大于7,表明添加生物炭后,试验地土壤的微生物群落可能就由以细菌为主变为了以真菌为主[35, 36],因为真菌比细菌更容易降解生物炭中的顽固性碳,能更好地在生物炭的孔隙中生长以及利用额外的资源[37]。一般认为在C/N高的土壤中真菌占优势,因为真菌比细菌对碳源的利用效率高,每单位生物量真菌比细菌需要的氮少[38-42],这也可能是B0处理和B20、B40、B60、B80处理的土壤微生物碳源代谢模式或功能具有相似性的原因,对此还需要通过分子生物学的方法进一步验证。
冬小麦整个生育期,土壤微生物量表现出明显的季节波动,说明其受降水、温度、湿度等季节性变化因素的影响[43]。当生物炭添加量为20 t/hm2时,显著增加了MBC的季节波动;当生物炭添加量为40~60 t/hm2时,显著增加了MBC/MBN的季节波动。这与张星等[7]和Chan等[11]的研究结果不同,原因有两点:一是所种植作物种类、生物炭类型及添加量不同导致的;二是添加生物炭影响了土壤中碳、氮的分解,改变了土壤微生物的组成和数量,从而增加了土壤微生物量碳及碳氮比的季节波动。
3.2 生物炭对土壤微生物碳源代谢活性的影响
当生物炭添加量大于40 t/hm2时,土壤微生物的整体代谢活性,土壤微生物对糖类、氨基酸类、多胺类碳源的利用率呈现降低的趋势,原因有以下两点:1) 从微生物量C、N、C/N的增长幅度来看,土壤微生物量碳的增长幅度明显大于微生物量氮,C/N增大,氮素缺乏可能是限制土壤中微生物活性的主要原因;2) 添加生物炭导致土壤群落组成发生变化[44],进而改变了土壤微生物利用碳源的种类。
土壤微生物群落酶链反应速度和最终能达到的程度与群落内能利用单一碳源微生物的数目和种类相关[45]。本研究中,添加生物炭能够降低土壤微生物的丰富度指数、Shannon–Wiener指数、Simpson指数,增加均匀度指数,这与前面讨论的外源生物炭的添加显著提高了土壤的C/N,有利于真菌菌落的生长相吻合,与武爱莲等[9]的试验结果一致,说明添加生物炭可以导致土壤微生物的群落结构趋于简单,从而降低土壤生态系统的稳定性,且生物炭在环境介质中的自然衰减过程可长达世纪之久[46],因此,实际应用中要严格控制生物炭的添加量,避免对土壤产生不良影响。
相关分析结果 (表6)表明,MBN与POC、NO3–-N呈显著负相关 (P < 0.05),与WSOC呈极显著负相关 (P < 0.01),MBC、MBP与有机碳及其易变组分、土壤速效养分之间并无显著相关关系;AWCD (168 h) 与AOC呈显著负相关 (P < 0.05),与NO3–-N呈极显著负相关 (P < 0.01),而与SOC、POC、WSOC、AP之间并无显著相关关系。说明土壤微生物量、土壤微生物碳源代谢活性受土壤有机碳及其易变组分、土壤速效养分的综合影响。
表 6 土壤微生物量、微生物碳源代谢活性及化学性质之间的相关性Table 6. Correlation among soil microbial biomass, microbial carbon metabolic activities and chemical properties指标Index MBC MBN MBP SOC POC AOC WSOC NO3–-N AP AWCD (168 h) MBC 1 MBN 0.302 1 MBP –0.432* –0.505* 1 SOC 0.222 –0.023 0.025 1 POC 0.145 –0.501* 0.25 0.670** 1 AOC 0.388 –0.288 0.137 0.476* 0.567** 1 WSOC –0.038 –0.528** 0.202 –0.199 0.102 0.142 1 NO3–-N 0.021 –0.436* 0.300 –0.084 0.450* 0.411* 0.008 1 AP 0.258 0.048 –0.062 –0.234 –0.136 0.437* –0.222 0.422* 1 AWCD (168 h) 0.008 0.394 –0.377 –0.170 –0.267 –0.425* –0.132 –0.510** –0.203 1 注(Note):MBC—微生物量碳 Microbial biomass carbon;MBN—微生物量氮 Microbial biomass nitrogen;MBP—微生物量磷 Microbial biomass phosphorus;SOC—有机碳 Soil organic carbon;POC—颗粒有机碳 Particulate organic carbon;AOC—易氧化有机碳 Active organic carbon;WSOC—水溶性有机碳 Water–soluble organic carbon;AP—速效磷 Available phosphorus;AWCD (168 h) —不同生育期 168 h 土壤微生物 AWCD 的平均值 Average values of AWCD for soil microorganisms in different growth periods within 168 h;*—P < 0.05;**—P < 0.01. 4. 结论
生物炭添加4~5年后,在第7季作物冬小麦生育期内,生物炭不同添加量对土壤微生物量及微生物功能多样性的影响依然有显著的差异。当生物炭添加量为40 t/hm2时,不仅可以显著提高土壤微生物量碳和C/N,显著降低土壤微生物量磷的季节波动,且能维持土壤微生物功能多样性不显著降低。可见,40 t/hm2是供试土保持土壤稳定性效果最佳的添加量,鉴于Biolog-ECO检测法仅能检测可培养的微生物,不能全面反映土壤微生物的多样性,仍需要对其内在的作用机制进行长期、深入的研究。
-
图 2 不同生育期土壤微生物量碳、氮、磷、碳/氮的动态变化
[注(Note):RGS—Returning green and setting;JB—Jointing and booting;FR—Filling and ripening;B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理 B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2. 柱上不同小写字母表示在同一生育期该指标不同处理间在0.05显著水平差异显著Different lowercase letters above the bars mean significant differences among treatments at the same growth period (P < 0.05).]
Figure 2. Dynamic changes of soil microbial biomass carbon, nitrogen, phosphorus and carbon/nitrogen ratio at different growth periods of winter wheat
表 1 2012—2015年7季作物品种及施肥量
Table 1 Fertilizer application rates and cultivars for different crop growing seasons during 2012 to 2015
播种时间 (yy-mm)
Sowing time供试作物
Crop type品种
Cultivar尿素 (N, kg/hm2)
Urea磷酸二铵 (P2O5, kg/hm2)
Diammonium phosphate硫酸钾 (K2O, kg/hm2)
Potassium sulphate2012–04 春玉米Spring corn 正大12 Zhengda 12 225 180 150 2012–10 冬小麦Winter wheat 小偃22 Xiaoyan 22 225 180 150 2013–06 夏玉米Summer corn 正大12 Zhengda 12 225 180 150 2013–10 冬小麦Winter wheat 小偃22 Xiaoyan 22 225 180 150 2014–06 夏玉米Summer corn 正大12 Zhengda 12 225 180 150 2015–04 辣椒Chilli 黑风Heifeng 0 0 0 2015–10 冬小麦Winter wheat 西农509 Xinong 509 225 180 150 表 2 不同处理下土壤微生物量的变异系数 (%)
Table 2 Variation coefficients of soil microbial biomass in different treatments
处理Treatment MBC MBN MBP MBC/MBN B0 31.29 bc 27.12 ab 58.06 a 8.93 b B20 39.35 a 32.26 a 21.60 c 26.45 ab B40 36.45 ab 29.22 a 42.90 b 46.92 a B60 34.14 ab 20.43 b 37.27 b 46.28 a B80 26.13 c 32.64 a 50.72 ab 28.63 ab 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;different lowercase letters within the same column indicate significant differences among treatments at 0.05 level. 表 3 土壤微生物功能多样性指数
Table 3 Functional diversity indices of soil microbial community
处理
Treatment丰富度指数
Richness indexShannon-Wiener指数
Shannon-Wiener index均匀度指数
Evenness indexSimpson指数
Simpson indexB0 22.71 ± 2.96 a 3.07 ± 0.11 a 0.99 ± 0.02 b 0.95 ± 0.01 a B20 22.04 ± 3.44 a 3.04 ± 0.13 ab 0.99 ± 0.02 ab 0.95 ± 0.01 ab B40 21.67 ± 3.23 ab 3.03 ± 0.12 ab 0.99 ± 0.02 ab 0.94 ± 0.01 ab B60 20.33 ± 3.80 b 2.98 ± 0.17 b 1.00 ± 0.02 a 0.94 ± 0.01 b B80 21.25 ± 4.53 ab 3.00 ± 0.18 b 0.99 ± 0.02 ab 0.94 ± 0.01 b 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;表中数值为平均值 ± 标准差;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;values in the table are mean ± SD;different lowercase letters in a column indicate significant differences among treatments at 0.05 level. 表 4 土壤微生物对不同碳源的利用率
Table 4 Use efficiencies of different carbon sources by soil microbial community
处理
Treatment氨基酸类
Amino acid糖类
Carbohydrate羧酸类
Carboxylic acid多聚物类
Polymer多酚化合物类
Aromatic chemical多胺类
AmineB0 1.14 ± 0.25 a 0.98 ± 0.18 a 0.85 ± 0.23 a 0.71 ± 0.22 a 0.42 ± 0.20 a 0.63 ± 0.33 a B20 1.13 ± 0.30 a 1.03 ± 0.17 a 0.87 ± 0.25 a 0.66 ± 0.23 a 0.44 ± 0.29 a 0.60 ± 0.44 a B40 1.14 ± 0.30 a 0.96 ± 0.22 a 0.77 ± 0.27 ab 0.66 ± 0.22 a 0.37 ± 0.29 a 0.63 ± 0.37 a B60 1.07 ± 0.33 a 0.92 ± 0.24 a 0.70 ± 0.25 b 0.71 ± 0.28 a 0.29 ± 0.22 a 0.48 ± 0.46 a B80 1.04 ± 0.44 a 0.95 ± 0.32 a 0.81 ± 0.39 ab 0.71 ± 0.28 a 0.39 ± 0.39 a 0.53 ± 0.48 a 注(Note):B0~B80 依次代表生物炭添加量为 0、20、40、60、80 t/hm2 的处理;表中数值为平均值 ± 标准差;同列数据后不同小写字母表示不同处理间差异显著 (P < 0.05)。B0–B80 represent biochar addition amounts of 0,20,40,60 and 80 t/hm2;values in the table are mean ± SD;different lowercase letters in a column indicate significant differences among treatments at 0.05 level. 表 5 主要碳源与第一、第二主成分 (PC1和PC2) 的相关系数 (r)
Table 5 Correlation coefficient r of main carbon sources with the 1st and the 2nd principle components (PC1 and PC2)
PC1 r PC1 r PC2 r 4-羟基苯甲酸p-Hydroxybenzoic acid 0.877 N-乙酰-D葡萄糖氨N-acetyl-D-glucosamine 0.758 肝糖Glycogen 0.754 D,L-α-磷酸甘油D,L-α-glycerophosphate 0.831 衣康酸Itaconic acid 0.757 丙酮酸甲酯Methyl pyruvate 0.661 D-纤维二糖D-(+)-Cellobiose 0.830 腐胺Putrescine 0.740 L-精氨酸L(+)-Arginine 0.826 γ-羟丁酸γ-hydroxybutyric acid 0.715 L-天门冬酰胺L-Aspartic acid 4-amide 0.797 D-甘露醇D-Mannitol 0.711 D-苹果酸D-Malic acid 0.782 吐温40 Tween 40 0.698 苯乙胺Phenylethylamine 0.760 L-苯丙氨酸L-Phenylalanine 0.688 表 6 土壤微生物量、微生物碳源代谢活性及化学性质之间的相关性
Table 6 Correlation among soil microbial biomass, microbial carbon metabolic activities and chemical properties
指标Index MBC MBN MBP SOC POC AOC WSOC NO3–-N AP AWCD (168 h) MBC 1 MBN 0.302 1 MBP –0.432* –0.505* 1 SOC 0.222 –0.023 0.025 1 POC 0.145 –0.501* 0.25 0.670** 1 AOC 0.388 –0.288 0.137 0.476* 0.567** 1 WSOC –0.038 –0.528** 0.202 –0.199 0.102 0.142 1 NO3–-N 0.021 –0.436* 0.300 –0.084 0.450* 0.411* 0.008 1 AP 0.258 0.048 –0.062 –0.234 –0.136 0.437* –0.222 0.422* 1 AWCD (168 h) 0.008 0.394 –0.377 –0.170 –0.267 –0.425* –0.132 –0.510** –0.203 1 注(Note):MBC—微生物量碳 Microbial biomass carbon;MBN—微生物量氮 Microbial biomass nitrogen;MBP—微生物量磷 Microbial biomass phosphorus;SOC—有机碳 Soil organic carbon;POC—颗粒有机碳 Particulate organic carbon;AOC—易氧化有机碳 Active organic carbon;WSOC—水溶性有机碳 Water–soluble organic carbon;AP—速效磷 Available phosphorus;AWCD (168 h) —不同生育期 168 h 土壤微生物 AWCD 的平均值 Average values of AWCD for soil microorganisms in different growth periods within 168 h;*—P < 0.05;**—P < 0.01. -
[1] 徐秋芳, 姜培坤, 王奇赞, 等. 绿肥对集约经营毛竹林土壤微生物特性的影响[J]. 北京林业大学学报, 2009, 31(6): 43-48. Xu Q F, Jiang P K, Wang Q Z, et al. Effects of green manure on soil microbial properties of Phyllostachys pubescens stands under intensive management[J]. Journal of Beijing Forestry University, 2009, 31(6): 43-48.
[2] 赵彤, 闫浩, 蒋跃利, 等. 黄土丘陵区植被类型对土壤微生物量碳氮磷的影响[J]. 生态学报, 2013, 33(18): 5615-5622. Zhao T, Yan H, Jiang Y L, et al. Effects of vegetation types on soil microbial biomass C, N, P on the Loess Hilly Area[J]. Acta Ecologica Sinica, 2013, 33(18): 5615-5622.
[3] Jenkinson D S, Andrew S P S, Lynch J M, et al. The turnover of organic carbon and nitrogen in soil[and Discussion][J]. Philosophical Transactions of the Royal Society B(Biological Sciences), 1990, 329(1255): 361-367. DOI: 10.1098/rstb.1990.0177
[4] Gross K, Cardinale B J, Fox J W, et al. Species richness and the temporal stability of biomass production: a new analysis of recent biodiversity experiments[J]. The American Naturalist, 2014, 183(1): 1-12. DOI: 10.1086/673915
[5] 张又弛, 李会丹. 生物炭对土壤中微生物群落结构及其生物地球化学功能的影响[J]. 生态环境学报, 2015, 24(5): 898-905. Zhang Y C, Li H D. Influence of biochar on the community structure and biogeochemical functions of microorganisms in soils[J]. Ecology and Environmental Sciences, 2015, 24(5): 898-905.
[6] Zavalloni C, Alberti G, Biasiol S, et al. Microbialmineralization of biochar and wheat straw mixture in soil: a short-term study[J]. Applied Soil Ecology, 2011, 50: 45-51. DOI: 10.1016/j.apsoil.2011.07.012
[7] 张星, 刘杏认, 张晴雯, 等. 生物炭和秸秆还田对华北农田玉米生育期土壤微生物量的影响[J]. 农业环境科学学报, 2015, 34(10): 1943-1950. DOI: 10.11654/jaes.2015.10.015 Zhang X, Liu X R, Zhang Q W, et al. Effects of biochar and straw direct return on soil microbial biomass during maize growth season in north China plain[J]. Journal of Agro-Environment Science, 2015, 34(10): 1943-1950. DOI: 10.11654/jaes.2015.10.015
[8] 陈伟, 周波, 束怀瑞. 生物炭和有机肥处理对平邑甜茶根系和土壤微生物群落功能多样性的影响[J]. 中国农业科学, 2013, 46(18): 3850-3856. DOI: 10.3864/j.issn.0578-1752.2013.18.014 Chen W, Zhou B, Shu H R. Effects of organic fertilizer and biochar on root system and microbial functional diversity of Malus Hupehensis Rehd[J]. Scientia Agricultura Sinica, 2013, 46(18): 3850-3856. DOI: 10.3864/j.issn.0578-1752.2013.18.014
[9] 武爱莲, 丁玉川, 焦晓燕, 等. 玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报, 2016, 24(6): 736-743. Wu A L, Ding Y C, Jiao X Y, et al. Effect of corn-stalk biochar on soil microbial functional diversity and bacterial community in cinnamon soils[J]. Chinese Journal of Eco-Agriculture, 2016, 24(6): 736-743.
[10] Castaldi S, RiondinoM, BarontiS, et al. Impact of biochar application to a Mediterranean wheat crop on soil microbial activity and greenhouse gas fluxes[J]. Chemosphere, 2011, 85(9): 1464-1471. DOI: 10.1016/j.chemosphere.2011.08.031
[11] Chan K Y, Van Zwieten L, Meszaros I, et al. Agronomic values of green waste biochar as a soil amendment[J]. Australian Journal of Soil Research, 2007, 45(8): 629-634. DOI: 10.1071/SR07109
[12] Jenkinson D S, Brookes P C, Powlson D S. Measuring soil microbial biomass[J]. Soil Biology and Biochemistry, 2004, 36(1): 5-7. DOI: 10.1016/j.soilbio.2003.10.002
[13] 李娟, 赵秉强, 李秀英, 等. 长期不同施肥制度下几种土壤微生物学特征变化[J]. 植物生态学报, 2008, 32(4): 891-899. DOI: 10.3773/j.issn.1005-264x.2008.04.018 Li J, Zhao B Q, Li X Y, et al. Changes of soil microbial properties affected by different long-term fertilization regimes[J]. Journal of Plant Ecology, 2008, 32(4): 891-899. DOI: 10.3773/j.issn.1005-264x.2008.04.018
[14] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. 176–179. Lu R K. Analytical methods of soil and agricultural chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000: 176–179.
[15] Page A L, Miller R H, Keeney Dennis R. Methods of soil analysis[J]. Catena, 1982, 15(1): 99-100.
[16] Brookes P C, Powlson D S, Jenkinson D S. Phosphorus in the soil microbial biomass[J]. Soil Biology and Biochemistry, 1984, 16(2): 169-175. DOI: 10.1016/0038-0717(84)90108-1
[17] Classen A T, Boyle S I, Haskins K E, et al. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils[J]. FEMS Microbiology Ecology, 2010, 44(3): 319-328.
[18] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006. Wu J S, Lin Q M, Huang Q Y, et al. Soil microbial biomass-methods and application[M]. Beijing: China Meteorological Press, 2006.
[19] Selmants P C, Hart S C, Boyle S I, et al. Red alder (Alnusrubra) alters community-level soil microbial function in conifer forests of the Pacific Northwest, USA[J]. Soil Biology and Biochemistry, 2005, 37(10): 1860-1868. DOI: 10.1016/j.soilbio.2005.02.019
[20] Fisk M C, Ruether K F, Yavitt J B. Microbial activity and functional composition among northern peat land ecosystems[J]. Soil Biology and Biochemistry, 2003, 35(4): 591-602. DOI: 10.1016/S0038-0717(03)00053-1
[21] 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性[J]. 生态学报, 2011, 31(18): 5225-5234. An S S, Li G H, Chen L D. Soil microbial functional diversity between rhizosphere and non-rhizosphere of typical plants in the hilly area of southern Ningxia[J]. Acta Ecologica Sinica, 2011, 31(18): 5225-5234.
[22] 张杰, 胡维, 刘以珍, 等. 鄱阳湖湿地不同土地利用方式下土壤微生物群落功能多样性[J]. 生态学报, 2015, 35(4): 965-971. Zhang J, Hu W, Liu Y Z, et al. Response of soil microbial functional diversity to different land-use types in wetland of Poyang Lake, China[J]. Acta Ecologica Sinica, 2015, 35(4): 965-971.
[23] 陈安强, 付斌, 鲁耀, 等. 有机物料输入稻田提高土壤微生物碳氮及可溶性有机碳氮[J]. 农业工程学报, 2015, 31(21): 160-167. DOI: 10.11975/j.issn.1002-6819.2015.21.021 Chen A Q, Fu B, Lu Y, et al. Exogenous organic materials applied to paddy field improving soil microbial biomass C, N and dissolved organic C, N[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(21): 160-167. DOI: 10.11975/j.issn.1002-6819.2015.21.021
[24] Zhang Z, Dijkstra A, Liu X R, et al. Effect of biochar on soil microbial biomass after four years of consecutive application in the North China Plain[J]. PloS One, 2014, 9(7): e102062. DOI: 10.1371/journal.pone.0102062
[25] 李中阳, 齐学斌, 樊向阳, 等. 生物质炭对冬小麦产量、水分利用效率及根系形态的影响[J]. 农业工程学报, 2015, 31(12): 119-124. DOI: 10.11975/j.issn.1002-6819.2015.12.016 Li Z Y, Qi X B, Fan X Y, et al. Influences of biochars on growth, yield, water use efficiency and root morphology of winter wheat[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(12): 119-124. DOI: 10.11975/j.issn.1002-6819.2015.12.016
[26] Kasozi G N, Zimmerman A R, Nkedi-Kizza P, et al. Catechol and humic acid sorption on to a range of laboratory-produced black carbons (biochars)[J]. Environmental Science and Technology, 2010, 44(16): 6189-6195. DOI: 10.1021/es1014423
[27] 贾夏, 董岁明, 周春娟. 微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响[J]. 应用基础与工程科学学报, 2013, 21(1): 10-19. DOI: 10.3969/j.issn.1005-0930.2013.01.002 Jia X, Dong S M, Zhou C J. Effects of Biolog Eco-plates incubation time on analysis results in microbial ecology researches[J]. Journal of Basic Science and Engineering, 2013, 21(1): 10-19. DOI: 10.3969/j.issn.1005-0930.2013.01.002
[28] 周凤, 许晨阳, 金永亮, 等. 生物炭对土壤微生物碳源代谢活性的影响[J]. 中国环境科学, 2017, 37(11): 4202-4211. DOI: 10.3969/j.issn.1000-6923.2017.11.025 Zhou F, Xu C Y, Jin Y L, et al. Effect of biochar on metabolic activity of soil microbial carbon[J]. China Environmental Science, 2017, 37(11): 4202-4211. DOI: 10.3969/j.issn.1000-6923.2017.11.025
[29] 王月玲, 耿增超, 王强, 等. 生物炭对塿土土壤温室气体及土壤理化性质的影响[J]. 环境科学, 2016, 37(9): 400-407. Wang Y L, Geng Z C, Wang Q, et al. Influence of biochar on greenhouse gases emissions and physico-chemical properties of loess soil[J]. Environmental Science, 2016, 37(9): 400-407.
[30] 尚杰, 耿增超, 赵军, 等. 生物炭对塿土水热特性及团聚体稳定性的影响[J]. 应用生态学报, 2015, 26(7): 1969-1976. Shang J, Geng Z C, Zhao J, et al. Effects of biochar on water thermal properties and aggregate stability of Lou soil[J]. Chinese Journal of Applied Ecology, 2015, 26(7): 1969-1976.
[31] 赵先丽, 程海涛, 吕国红, 等. 土壤微生物生物量研究进展[J]. 气象与环境学报, 2006, 22(4): 68-72. DOI: 10.3969/j.issn.1673-503X.2006.04.013 Zhao X L, Cheng H T, Lv G H, et al. Advances in soil microbial biomass[J]. Journal of meteorology and environment, 2006, 22(4): 68-72. DOI: 10.3969/j.issn.1673-503X.2006.04.013
[32] Anderson J P E, Domsch K H. Quantities of plant nutrients in the microbial biomass of selected soils[J]. Soil Science, 1980, 130(4): 211-216. DOI: 10.1097/00010694-198010000-00008
[33] Campbell C A, Biederbeck V O, Zentner R P, et al. Effect of crop rotations and cultural practices on soil organic matter, microbial biomassand respiration in a thin Black Chernozem[J]. Canadian Journal of Soil Science, 1991, 71(3): 363-376. DOI: 10.4141/cjss91-035
[34] Jenkinson D S. The effects of biocidal treatments on metabolism in soil-IV. The decomposition of fumigated organisms in soil[J]. Soil Biology and Biochemistry, 1976, 8(3): 203-208. DOI: 10.1016/0038-0717(76)90004-3
[35] O’Neill B, Grossman J, Tsai M T, et al. Bacterial community composition in brazilian anthrosols and adjacent soil scharacterizedusing culturing and molecular identification[J]. Microbial Ecology, 2009, 58(1): 23-35. DOI: 10.1007/s00248-009-9515-y
[36] Khodadad C L M, Zimmerman A R, Green S J, et al. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology & Biochemistry, 2011, 43(2): 385-392.
[37] Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota-A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI: 10.1016/j.soilbio.2011.04.022
[38] DeDeyn G B, Cornelissen J H, Bardgett R D. Plant functional traits and soil carbon sequestration in contrasting biomes[J]. Ecology letters, 2008, 11(5): 516-531. DOI: 10.1111/j.1461-0248.2008.01164.x
[39] Fierer N, Strickland M S, Liptzin D, et al. Global patterns in belowground communities[J]. Ecology Letters, 2009, 12(11): 1238-1249. DOI: 10.1111/ele.2009.12.issue-11
[40] Keiblinger K M, Hall E K, Wanek W, et al. The effect of resource quantity and resource stoichiometry on microbialcarbon-use-efficiency[J]. FEMS Microbiology Ecology, 2010, 73(3): 430-440.
[41] Waring B G, Averill C, Hawkes C V. Differences in fungal and bacterial physiology alter soil carbon and nitrogen cycling: insights from meta-analysis and theoretical models[J]. Ecology Letters, 2013, 16(7): 887-894. DOI: 10.1111/ele.12125
[42] Ng E L, Patti A F, Rose M T, et al. Functional stoichiometry of soil microbial communities after amendment with stabilized organic matter[J]. Soil Biology and Biochemistry, 2014, 76(1): 170-178.
[43] 许文欢, 邓芳芳, 方水元, 等. 生物炭对杨树人工林土壤微生物量及碳源代谢多样性的影响[J]. 南京林业大学学报, 2016, 40(5): 14-20. Xu W H, Deng F F, Fang S Y, et al. Effect of biochar on soil microbial biomass and the diversity of carbon source metabolism in poplar plantation[J]. Journal of Nanjing Forestry University, 2016, 40(5): 14-20.
[44] Tong H, Hu M, Li F B, et al. Biochar enhances the microbial and chemical transformation of pentachlorophenol in paddy soil[J]. Soil Biology and Biochemistry, 2014, 70: 142-150. DOI: 10.1016/j.soilbio.2013.12.012
[45] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology[J]. FEMS Microbiology Ecology, 1997, 24(4): 289-300. DOI: 10.1111/j.1574-6941.1997.tb00446.x
[46] 姚玲丹, 程广焕, 王丽晓, 等. 施用生物炭对土壤微生物的影响[J]. 环境化学, 2015, 34(4): 697-704. DOI: 10.7524/j.issn.0254-6108.2015.04.2014072802 Yao L D, Cheng G H, Wang L X, et al. Effects of biochar application to microorganisms in soil[J]. Environmental Chemistry, 2015, 34(4): 697-704. DOI: 10.7524/j.issn.0254-6108.2015.04.2014072802
-
期刊类型引用(19)
1. 吴乐诗,李冬琴,黎华寿,陈桂葵. 生物炭影响农田温室气体排放的研究进展. 生态科学. 2024(01): 257-264 .  百度学术
百度学术
2. 焦冉,周志强. 基于生物炭技术的园林废弃物处理途径研究. 山东林业科技. 2024(02): 22-29 .  百度学术
百度学术
3. 祝志一. 生物炭对CO_2气体吸收排放影响的研究进展. 内蒙古石油化工. 2024(05): 10-15 .  百度学术
百度学术
4. 李澳,任志超,李想,李彦周,王景,穆耀辉,刘国顺,殷全玉. 生物炭对不同黑胫病抗性烤烟品种根际土壤细菌群落结构的影响. 山东农业科学. 2024(10): 102-112+126 .  百度学术
百度学术
5. 鹿子晨,李明,薛国萍,胡云,薛海峰,王亚萍,王雪玉. 生物炭对连作土壤微生物群落影响研究进展. 蔬菜. 2024(11): 21-28 .  百度学术
百度学术
6. 徐彬,王小利,段建军,杨宏伟,龙大勇,蒙婼熙,梅婷婷. 生物炭投入对稻田土壤微生物量碳氮及水稻品质的影响. 耕作与栽培. 2023(01): 1-6 .  百度学术
百度学术
7. 胡颖槟,梁辰飞,金锦,王潇璇,叶子豪,吴家森. 长期生草栽培对山核桃人工林土壤真菌群落和酶活性的影响. 环境科学. 2023(05): 2945-2954 .  百度学术
百度学术
8. 丁玮,阳树英,刘洋,张亚宁,张波. 广东潮土生物炭对不同水稻品种的土壤细菌群落的影响. 华南农业大学学报. 2022(03): 42-49 .  百度学术
百度学术
9. 肖怡,李峥,黄容,汤奥涵,李冰,王昌全. 有机物料还田对稻田土壤DOM碳源代谢能力的影响. 环境科学. 2022(07): 3884-3894 .  百度学术
百度学术
10. 陈懿,林英超,杨志晓,程建中,王志红,孔德钧,吴春,林叶春. 炭基肥对黄壤烤烟生理和氮素吸收与平衡的影响. 土壤学报. 2022(06): 864-872 .  百度学术
百度学术
11. 陈懿,林英超,杨志晓,程建中,王志红,孔德钧,吴春,林叶春. 炭基肥对黄壤烤烟生理和氮素吸收与平衡的影响. 土壤学报. 2022(03): 864-872 .  百度学术
百度学术
12. 刘丽君,朱启林,李凯凯,李淼,孟磊,伍延正,汤水荣,何秋香. 添加生物炭对海南燥红壤N_2O和CO_2排放的影响. 农业环境科学学报. 2021(09): 2049-2056 .  百度学术
百度学术
13. 孙娇,梁锦秀,孔德杰,郭鑫年,魏永东,周涛. 生物炭与秸秆还田对风沙土壤-微生物-胞外酶化学计量特征的影响. 草业学报. 2021(11): 29-39 .  百度学术
百度学术
14. 吴丹,孙萍,路鹏展,陈友媛,郭嘉梦,刘明,王磊,张彩杰. 浒苔生物炭对滨海盐碱土壤改良的效果及途径. 环境科学. 2020(04): 1941-1949 .  百度学术
百度学术
15. 王强,耿增超,许晨阳,郭靖宇,李倩倩,刘莉丽,赵汉红,杜旭光. 施用生物炭对塿土土壤微生物代谢养分限制和碳利用效率的影响. 环境科学. 2020(05): 2425-2433 .  百度学术
百度学术
16. 程会丹,鲁艳红,聂军,朱启东,聂鑫,曹卫东,高雅洁,廖育林. 减量化肥配施紫云英对稻田土壤碳、氮的影响. 农业环境科学学报. 2020(06): 1259-1270 .  百度学术
百度学术
17. 王义祥,黄家庆,叶菁,李艳春,林怡,刘岑薇. 生物炭对酸化茶园土壤性状和细菌群落结构的影响. 植物营养与肥料学报. 2020(11): 1967-1977 .  本站查看
本站查看
18. 高文翠,杨卫君,贺佳琪,贾永红,徐万里,马海刚. 生物炭添加对麦田土壤微生物群落代谢的影响. 生态学杂志. 2020(12): 3998-4004 .  百度学术
百度学术
19. 徐广平,滕秋梅,沈育伊,邱正强,张德楠,何成新,牟海飞,周龙武,韦绍龙,牟芝熠. 香蕉茎叶生物炭对香蕉枯萎病防控效果及土壤性状的影响. 生态环境学报. 2020(12): 2373-2384 .  百度学术
百度学术
其他类型引用(21)



 下载:
下载: