Optimum levels of Paecilomyces variotii extracts in regulating resistance of rice seedlings to low temperature stress
-
摘要:目的
施用生物刺激素是可持续农业中缓解作物低温胁迫的重要措施。本文主要研究了本课题组从野生沙棘内生菌提取的一种新型生物刺激素(宛氏拟青霉提取物)增强水稻抗低温胁迫的最佳施用浓度和生物学机制。
方法通过室内培养,于野生沙棘体内分离出宛氏拟青霉 (Paecilomyces variotii) 菌株,菌株再经发酵和提纯获得供试生物刺激素PVE (Paecilomyces variotiiextracts)。以水稻为试验材料设置了萌发和液培试验,试验设0、0.05、0.10、0.20、0.50和1.00 μg/L 6个PVE施用水平,研究了低温 (15℃) 胁迫下不同浓度PVE对水稻种子萌发、幼苗生长、根系发育、光合特性和氧化损伤的影响。
结果1)施用PVE的各处理提前打破了种子休眠,种子发芽率在第5天和第6天较CK分别提高66.7%~106.7%和28.2%~47.8%。2) PVE在0.05~0.50 μg/L浓度范围较CK显著增加地上部生物量7.9%~20.4%,提高了根系重量12.5%~28.1%。3) PVE在0.10 μg/L浓度条件下,较CK显著提高水稻总根长、根表面积、根体积和根平均直径48.0%、36.6%、36.2%和35.2%。4) PVE在0.05~0.50 μg/L浓度范围较CK显著提高水稻叶片光合速率5.1%~34.4%,并提高了叶片气孔导度和蒸腾速率。5) PVE在0.10 μg/L浓度条件下较CK显著提高叶片SOD、CAT和POD活性46.9%、9.6%和18.4%,提高根系SOD、CAT和POD活性28.0%、12.7%和16.4%,并显著降低叶片和根系中MDA含量22.0%和29.8%。6) PVE在0.05~0.50 μg/L浓度范围内均具有缓解低温胁迫的能力,以0.10 μg/L为最佳施用浓度。当超过0.10 μg/L,PVE对低温胁迫的缓解能力随着施用浓度的提升反而减弱。
结论PVE在0.10 μg/L的浓度下可提高叶片光合能力和减少细胞氧化损伤,增加根系吸收养分的面积,显著缓解低温对水稻幼苗的胁迫。建议PVE的施用水平为0.10 μg/L。
Abstract:ObjectivesBiostimulants are capable of alleviating abiotic stress, especially low temperature stress, and have been widely used in agriculture production. We extracted and testified a new type of biostimulant from the endophytic fungus in wild sea buckthorn. The proper dosage for the best effect was studied for rice seedlings against low temperature stress.
MethodsThe tested Paecilomyces variotii extracts (PVE) was obtained through fermentation and purification of the strain Paecilomyces variotii. Germination and hydroponic pot experiments were conducted using rice as tested materials. The rice seeds were germinated and grown in nutrient solution under low temperature stress (15℃). The treated PVE dosages in the nutrient solution were 0, 0.05, 0.10, 0.20, 0.50 and 1.00 μg/L, respectively. The seed germination rate, activities of antioxidant enzymes (SOD, POD and CAT), indices of photosynthetic and growth of rice seedlings were measured.
ResultsComparing with no PVE (CK), the germination rates of rice seeds in PVE treatments were increased by 66.7%–106.7% on the 5th day, and by 28.2%–47.8% on the 6th day; the aboveground biomass increased by 7.9%–20.4% and the root weights by 12.5%–28.1% in the concentration range of 0.05–0.50 μg/L; the total root length, root surface area, root volume and average root diameter were increased by 48.0%, 36.6%, 36.2% and 35.2% under PVE concentration of 0.10 μg/L, respectively. Within the PVE concentrations of 0.05–0.50 μg/L, the photosynthetic rate of rice leaves was significantly increased from 5.1% to 34.4%, and the stomatal conductance and transpiration rate of leaves were increased as well. Under PVE concentration of 0.10 μg/L, the SOD, CAT and POD activities in leaves were increased by 46.9%, 9.6% and 18.4%, and those in roots were increased by 28.0%, 12.7% and 16.4%; the MDA contents in leaves and roots were reduced by 22.0% and 29.8%, respectively. The PVE could alleviate low temperature stress in the range of 0.05–0.50 μg/L, with the best effect in concentration of 0.10 μg/L.
ConclusionsPVE could alleviate the low temperature stress of rice seedlings by increasing nutrient uptake area of roots, leaf photosynthetic capacity and reducing cellular oxidative damage at 0.10 μg/L concentration. The appropriate dosage of PVE is 0.10 μg/L.
-
水稻是对温度极为敏感的喜温性作物[1],随着全球极端性的低温冷害事件频频发生[2],低温冷害成为制约水稻生产的重要因素[3]。每年全球水稻因冷害减产5%~10%,严重时甚至可达到20%~40%[4]。当环境温度低于15℃时,水稻的生理代谢就会受到影响[5]。短时间内冷害会导致水稻生长迟缓,若低温持续时间过长,秧苗会出现腐烂甚至死亡[6]。冷害不仅会对水稻造成明显的外部损伤,还会对一系列的生理和代谢过程造成不可逆的伤害[7],如破坏细胞膜透性[8]、抑制叶绿素合成[9]、造成电解质泄漏[10],降低叶片光合能力等[11]。水稻二叶期胚乳中的养分消耗殆尽,是水稻抗性最弱的时期,极易遭受冷害,最终影响水稻产量[12]。我国北方水稻通常在5月份进行育秧,此时地下水温度低、昼夜温差大。因此,提高低温条件下水稻幼苗的耐寒能力对促进水稻成苗和秧苗生长有重要作用。目前水稻生产中应对突发的低温气候,通常以喷施抗冷药剂等外源物质的方式来提高水稻的抗低温能力从而防御冷害的发生[13]。但我国对于抗寒外源物质的研究较为缓慢,因此急需一种稳定、高效的外源物质用于提高水稻的耐寒能力。
生物刺激素在2012年被欧洲生物刺激素工业理事会 (EBIC) 定义为:一种施用于植物表面或根际后能够刺激植物增强养分吸收能力,提高养分利用效率,提高作物品质以及降低非生物胁迫的外源添加物质或微生物[14]。全球生物刺激素市场在2013至2018年间以每年12.5%的速度迅速增长,至2018年生物刺激素的销售额已达22.41亿美元[15]。随着生物刺激素在农业中的应用不断增多,生物刺激素的增效方式和作用机理也逐渐被认知。孙磊等[16]通过不同浓度的低聚壳聚糖对水稻幼苗进行处理,证明低聚壳聚糖能够保护类囊体膜系统,缓解低温对光合系统的破坏,从而增强了水稻幼苗对低温的耐受性。张水勤等[17]研究发现腐植酸能够固持活化土壤和肥料中的养分,刺激植物根系伸长,加速对养分的吸收,并显著缓解逆境胁迫。邓如福等[18]发现海藻糖能够降低低温胁迫下水稻幼苗细胞电解质渗漏速率,并提高了植株体内淀粉酶活性和可溶性糖含量,在维持细胞膜结构稳定的同时能够对寒害进行修复。国内外的大量研究也表明,蛋白质水解物和特定的氨基酸,包括脯氨酸、甜菜碱等还能够诱导植物防御反应,提高植物对极端温度的耐受性[15]。因此,生物刺激素的施用不仅能够促进作物生长、氮素代谢以及养分累积,更是可持续农业中缓解冷害的重要手段和希望[19]。沙棘 (Hippophae rhamnoides L.) 是我国用于水土保持和荒漠治理的重要经济树种,其根系发达、抗逆性强,能够提高土壤氮储量,增加土壤水稳性团聚体含量[20-21]。试验通过野生沙棘内生菌发酵提取了一种新型生物刺激素PVE(Paecilomyces variotii extracts),继而通过发芽试验和液培试验研究了低温胁迫下PVE对水稻种子萌发、幼苗生长、光合作用和抗氧化损伤能力的影响,为探寻该生物刺激素的最适施用浓度及应用于农业生产提供参考依据。
1. 材料与方法
1.1 试验材料
试验于2018年7月在山东省泰安市山东农业大学国家工程实验室进行。
供试生物刺激素的制备方法为[22]:将冲洗干净后的野生沙棘根系切成小段,经75%的酒精和10%的巴氏消毒液浸洗后,用无菌水冲洗干净。在超净台上将根切割成0.5 cm长的小段后接种于孟加拉红平板培养基,28℃下培养5天。此时切割过的根系边缘会长出菌丝,菌丝经反复分离纯化后即得沙棘内生菌菌株 (宛氏拟青霉Paecilomyces variotii)。
将宛氏拟青霉菌株 (保藏号CGMCCNO.10114) 接种到平板PDA培养基上于25℃下培养6天。随后转接于装有50 mL种子培养液的250 mL三角烧瓶内并在28℃、120 rpm的全自动摇床上培养3天,再以10%量接种入装有150 mL发酵培养基的500 mL三角瓶中,继续在相同条件下培养5天后终止发酵,放置于4℃冰箱中保存。将培养得到的菌丝体洗净后在60℃下烘干称重,经高速粉碎机粉碎,乙醇浸提3次,磁力搅拌器混匀后超声波震荡1 h,真空抽滤所得滤液即为宛氏拟青霉菌株的提取物PVE。其成分包含分子量140~2507 Da的小分子寡糖、氨基酸、嘧啶核苷、糖蛋白和多肽等物质。
萌发试验中供试方板的规格为10 cm × 10 cm;液培装置由硬质PVC管改良组装制成,高12.5 cm,直径9.5 cm,底部完全封闭,顶部设计为直径10.5 cm的盖子,并在盖子上钻出4个直径1.5 cm的圆孔。水稻种子通过海绵固定于圆孔中。
供试水稻品种为“圣稻13”,生育期为156天,属于中晚熟常规粳稻。
1.2 试验方法及设计
发芽试验:试验共设6个处理,3次重复。选取大小均一的水稻种子,于5%的NaClO溶液中浸泡10 min消毒后用无菌水洗净。消毒后的水稻种子分别在含PVE 0、0.05、0.10、0.20、0.50和1.00 μg/L的水溶液中浸种24 h。浸种结束后用无菌水冲洗、擦干,将种子整齐排放于底部铺有两层滤纸的方板中,每个方板点种50粒,每天定时补水保持方板重量恒定。所有方板均在15℃的恒温培养箱内培养,种子发芽后每天统计发芽率直至全部发芽。
液培试验:选取大小均一的水稻种子,用5% NaClO溶液消毒洗净后,均匀撒播于装有细沙的长方形塑料盒中,定时补水培养至两叶一心期。此时将水稻幼苗转移至装有1/20国际水稻研究所标准营养液 (IRRI) 的液培装置中,营养液包括PVE处理浓度分别为0、0.05、0.10、0.20、0.50和1.00 μg/L,于15℃恒温培养箱中培养,每两天更换一次营养液,并随着水稻幼苗的生长逐步提高营养液浓度 (各处理PVE浓度不变),每个处理重复3次。10天后进行样品采集与相关指标的测定。
1.3 样品采集及测定方法
生物量,将叶片与根系用蒸馏水洗净后,置于烘箱中105℃杀青1 h,然后在75℃下烘干至恒重。根系形态,采用LA-S植物根系分析系统 (杭州万深) 扫描并拍摄;叶片光合速率 (Pn),用LI-6400XT便携式光合仪 (LI-COR,美国) 测定,样品测定的时间为9:00—11:00;植株叶片SPAD值,用SPAD-502叶绿素仪 (Minolta,日本) 测定;叶绿素含量,用95%乙醇浸提,紫外分光光度计测定665、649和 470 nm处的光吸收值[23]。超氧化物歧化酶 (SOD) 活性,用氮蓝四唑 (NBT) 光化学还原法测定[24];过氧化物酶 (POD) 活性,采用愈创木酚法测定[24];过氧化氢酶 (CAT) 活性,采用过氧化氢紫外吸收法测定[24];丙二醛 (MDA) 含量,用硫代巴比妥酸 (TBA) 法测定[24];
1.4 数据分析方法
发芽率 (%) = 发芽数/50 × 100,其中芽长超过种身长度的1/2记为有效发芽。
根冠比 (%) = 地下部分干重/地上部分干重 × 100。
水稻根系扫描数据采用万深LA-S根系分析系统分析,其余数据通过Excel 2016和SAS 8.2软件进行处理和统计分析,采用ANOVA方差分析及Duncan’s Multiple Range Test方法比较不同处理间在P < 0.05水平的差异显著性。
2. 结果与分析
2.1 不同PVE浓度对水稻种子萌发的影响
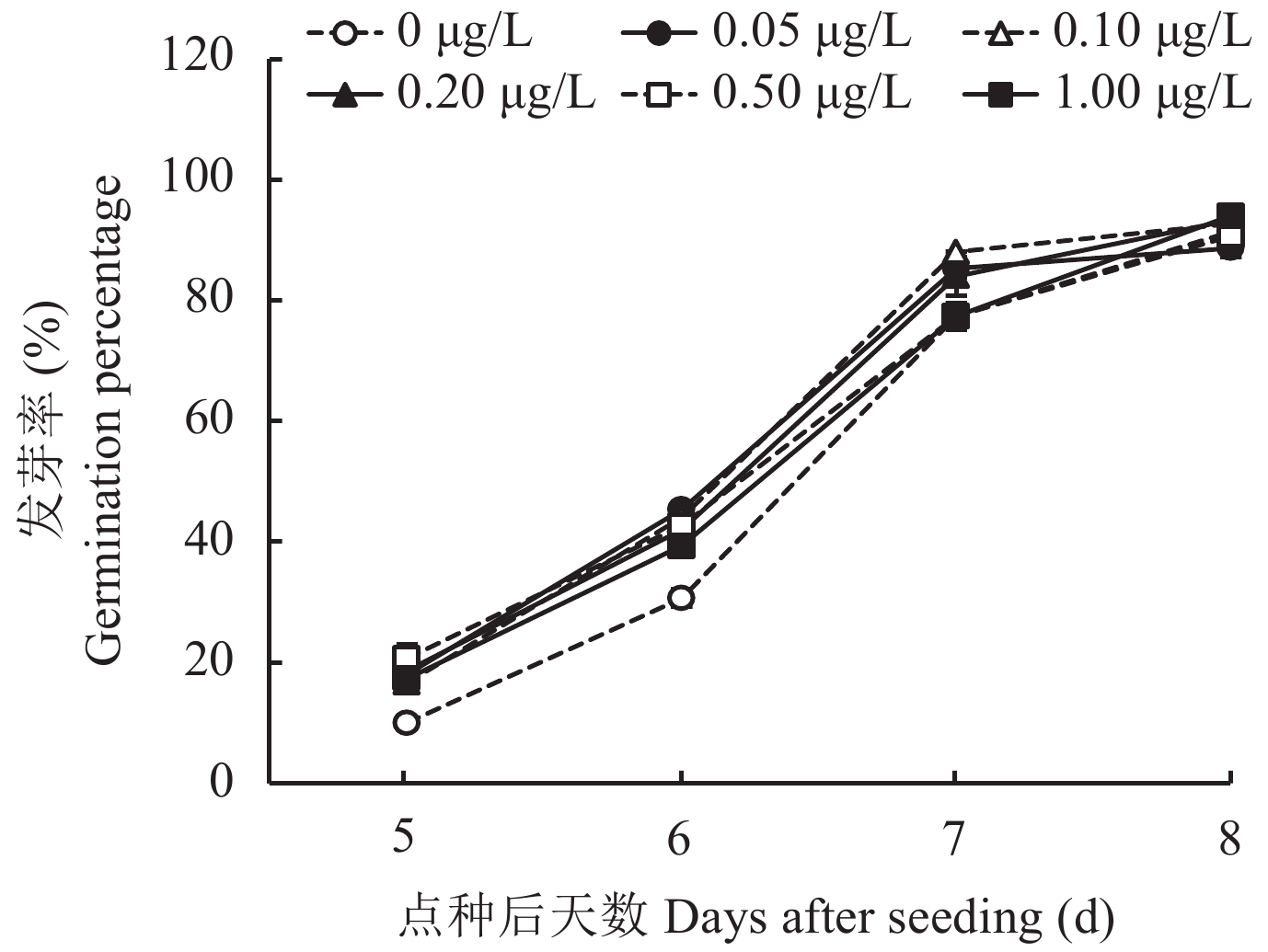
低温会抑制水稻种子的萌发,各处理水稻种子直至第5天才开始发芽 (图1)。施用PVE的处理在第5天和第6天种子发芽率较CK分别提高66.7%~106.7%和28.2%~47.8%。至第7天,只有0.05与0.10 μg/L处理种子发芽率高于CK,其余浓度处理与CK无明显差异。第8天所有处理种子发芽基本结束,各处理水稻平均发芽率均在88%以上,且所有处理间种子发芽率无明显差异。提前发芽是打破种子休眠、缩短水稻生育期的重要手段,综合来看,PVE对低温胁迫下种子发芽率没有影响,但能够促进种子提前发芽。
2.2 不同PVE浓度对水稻幼苗地上部分生物量、根重及根冠比的影响
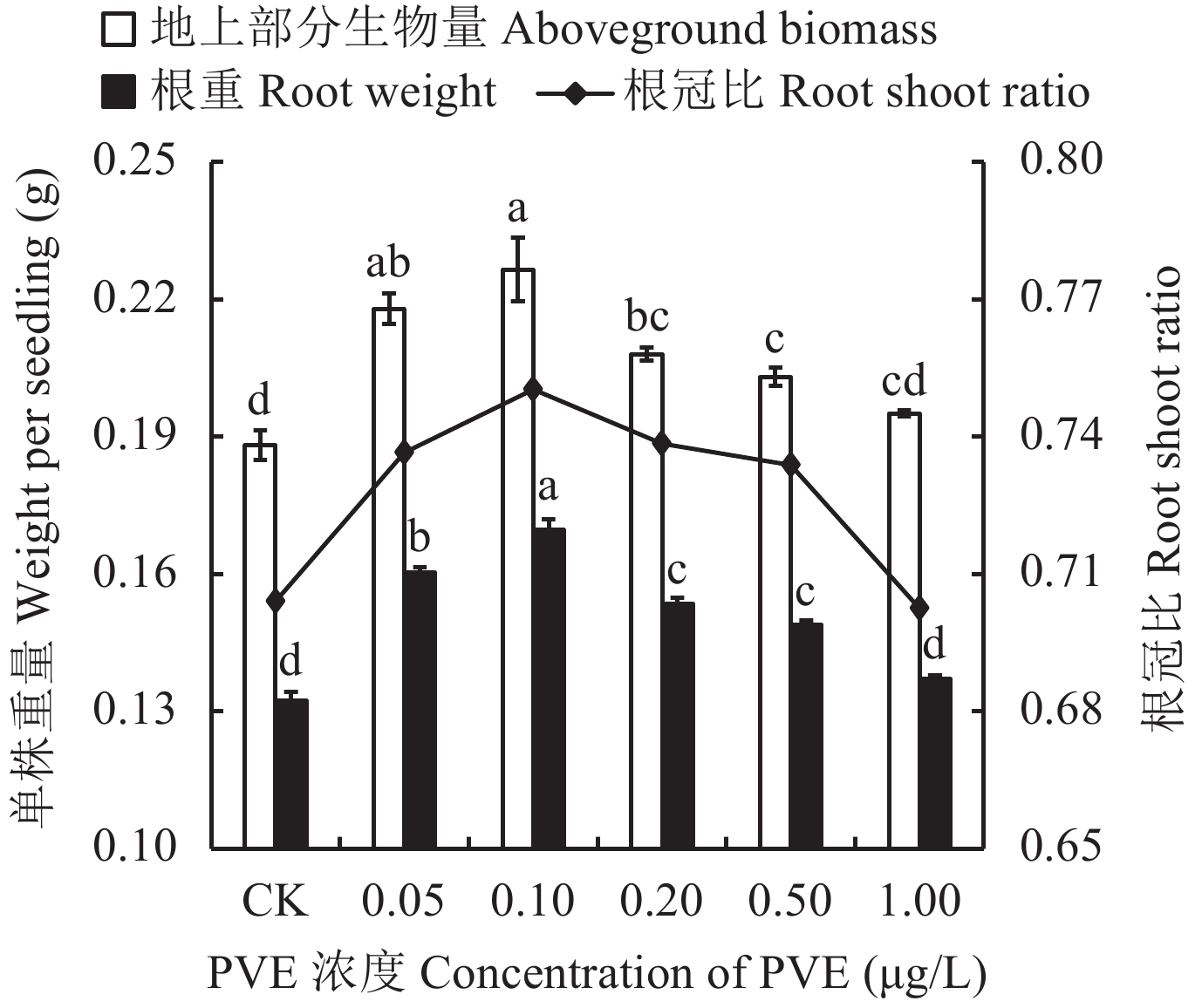
图2表明,PVE在0.05~0.50 μg/L浓度范围内可显著提高水稻地上部分生物量7.9%~20.4%,增加水稻根系重量12.5%~28.1%,提高水稻幼苗的根冠比4.2%~6.6%,以0.10 μg/L促生作用最大。当PVE的施用浓度达1.00 μg/L时,水稻地上部分生物量、根重和根冠比均与CK无显著差异。
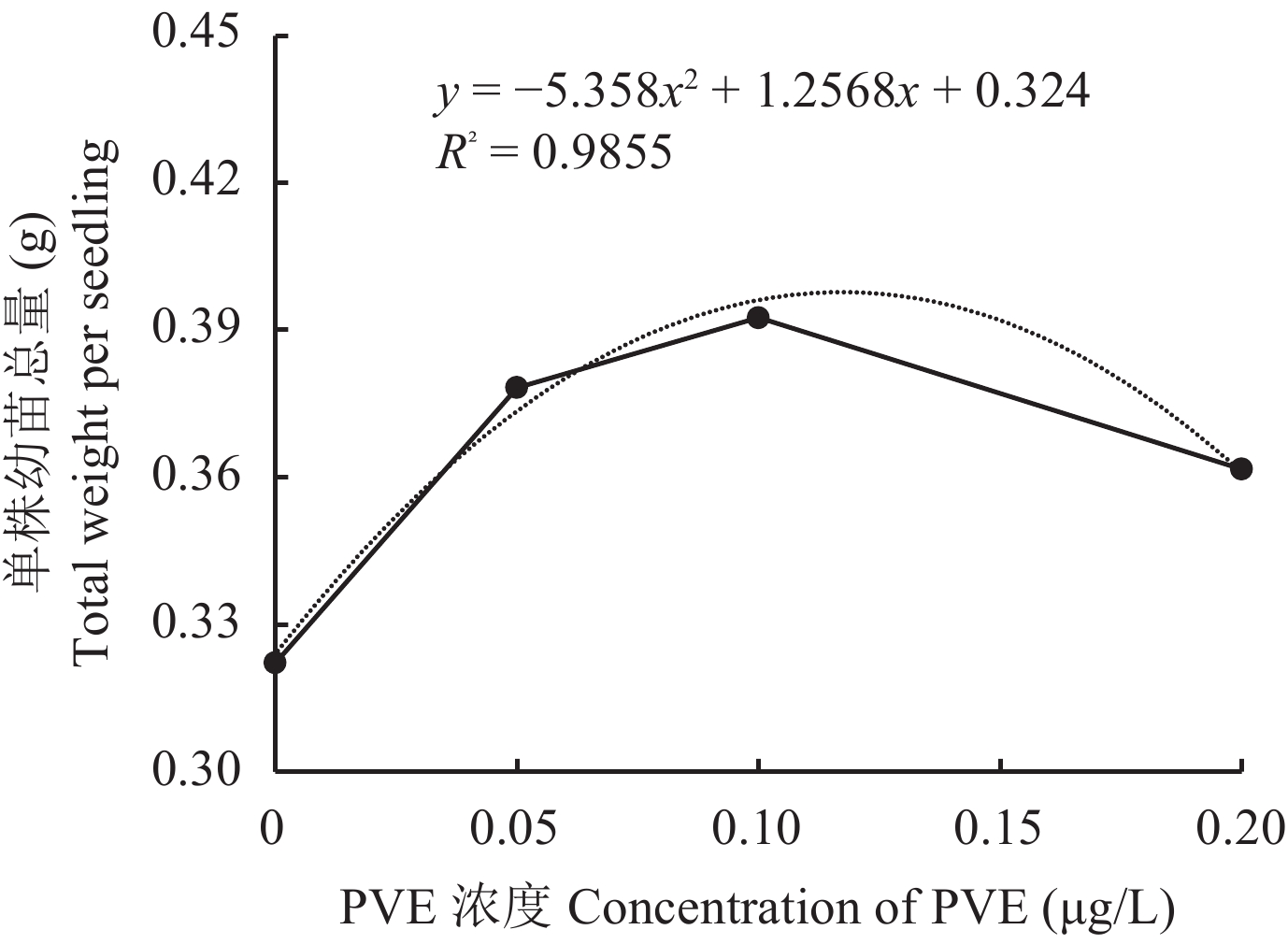
对0~0.20 μg/L范围内PVE浓度 (x) 与水稻幼苗地上部分和根系总重 (y) 进行相关性分析 (图3),得到关系为y = -5.5358 x2 + 1.2568 x + 0.324(R2 = 0.9855) 的函数方程。从中可以看出在PVE浓度 (x) = 0.1173 μg/L时,水稻幼苗总重 (y) 可取得最大值,高于这个浓度,PVE的促生效果开始下降,过高的浓度可能还会抑制水稻幼苗的生长。
2.3 不同PVE浓度对水稻根系形态和生长发育的影响
PVE在低浓度条件下能够缓解低温胁迫,改善水稻根系生长状况 (表1)。与对照相比,0.05 μg/L处理水稻根系总长度、投影面积、面积、根表面积、根体积和根系平均直径分别显著提高38.0%、46.5%、47.1%、34.5%、31.0%和31.5%;0.10 μg/L处理根系各项指标分别显著提高48.0%、48.5%、41.8%、36.6%、36.2%和35.2%。0.05和0.10 μg/L的PVE促进了根系生长与伸长,而发达的根系能够提高水稻幼苗对水分和养分的吸收能力,进而缓解低温对水稻幼苗的胁迫。超过0.20 μg/L,PVE的有益作用下降,并显著低于0.05与0.10 μg/L处理。
表 1 不同PVE浓度处理水稻根系形态Table 1. Root morphology of rice under different PVE concentrationsPVE浓度 (μg/L)
PVE concentration总长度 (mm)
Total length投影面积 (mm2)
Projection area面积 (mm2)
Area表面积 (mm2)
Surface area根体积 (mm3)
Root volume平均直径 (mm)
Average diameter0 (CK) 192.5 c 12.8 d 10.9 c 44.9 c 1.22 d 0.36 c 0.05 265.6 ab 18.8 a 16.0 a 60.4 a 1.59 a 0.47 a 0.10 285.0 a 19.1 a 15.4 a 61.3 a 1.66 a 0.49 a 0.20 243.0 b 16.6 b 13.7 b 55.3 b 1.47 b 0.42 b 0.50 217.1 c 15.8 b 13.2 b 50.5 b 1.36 c 0.39 bc 1.00 208.4 c 14.7 c 13.1 b 45.1 c 1.31 cd 0.36 c 注(Note):同列数值后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments ( P < 0.05). 2.4 不同PVE浓度对水稻叶片SPAD值及叶绿素含量的影响
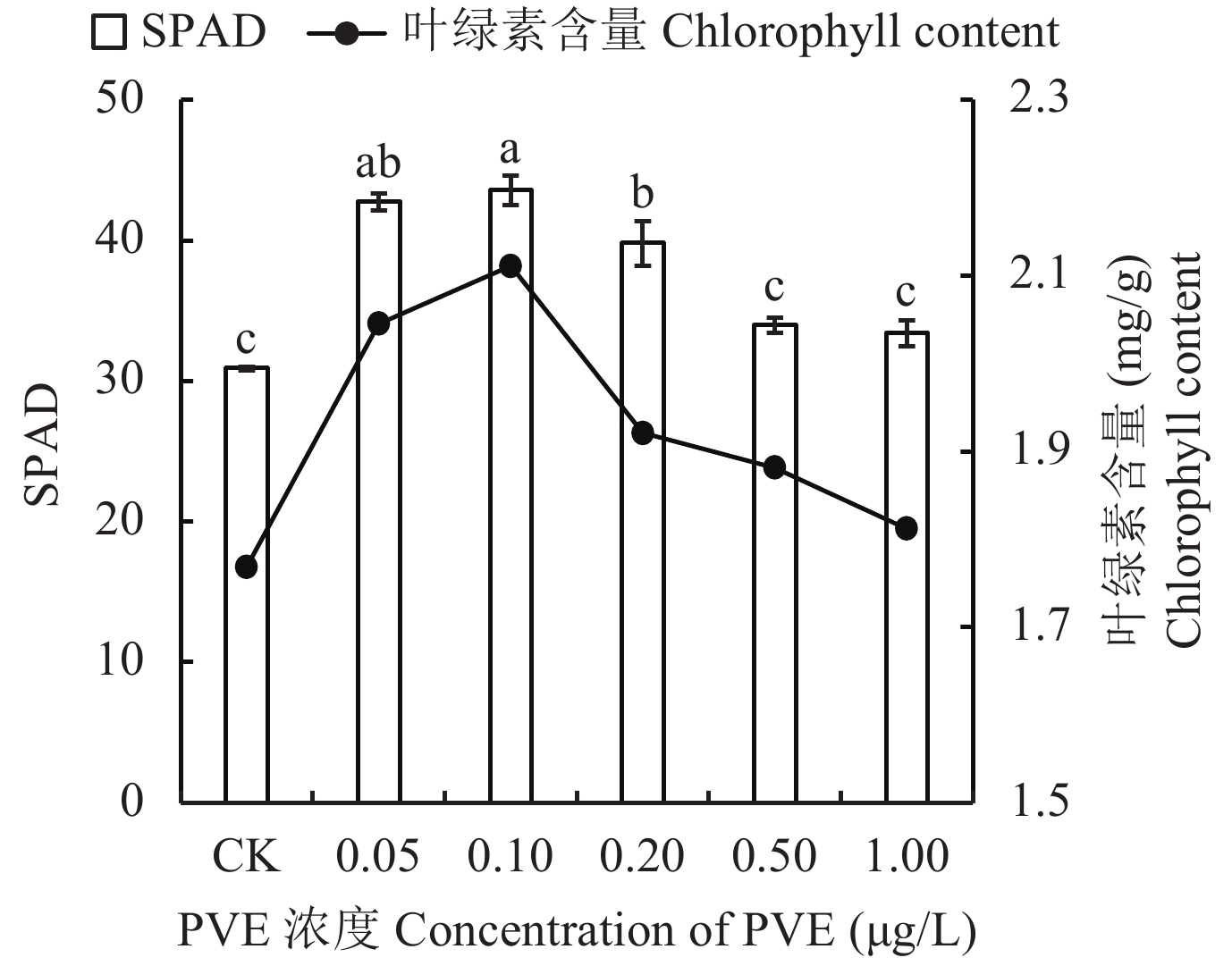
叶绿素是植物光合作用中起核心作用的色素,其含量是反映叶片光合能力强弱的重要指标。SPAD值与叶绿素含量有良好的相关性,通过测定不同处理水稻叶片SPAD值 (图4),发现0.05、0.10和0.20 μg/L处理叶片SPAD值较CK分别显著提升38.2%、40.9%和28.7%,其中0.10 μg/L处理SPAD值最高。但随着PVE施用浓度的进一步提高,叶片SPAD值逐渐降低,0.20、0.50和1.00 μg/L处理叶片SPAD值较0.10 μg/L处理分别降低了8.7%、22.0%和23.3%,且0.50与1.00 μg/L处理叶片SPAD值与CK已无显著差异。水稻叶片中的叶绿素含量与SPAD值呈现的规律相一致,0.05、0.10和0.20 μg/L处理叶绿素含量较CK提高了15.6%、19.3%和8.6%,0.50和1.00 μg/L处理叶片叶绿素含量较0.10 μg/L处理分别显著降低10.8%和14.2%,并与CK叶绿素含量差异不显著。因此,叶绿素合成对PVE施用浓度存在明显响应,0.10 μg/L PVE是促进叶绿素合成的最佳浓度。
2.5 不同PVE浓度对水稻叶片光合特性的影响
光合作用是水稻捕捉太阳能并进行养分累积的基础,叶片的光合能力直接决定了植物生产力的高低,是植物光合作用的重要反映。PVE在0.05~0.50 μg/L浓度范围内水稻叶片光合速率较CK显著提高5.1%~34.4% (表2),且0.05和0.10 μg/L处理叶片光合速率显著高于0.20、0.50和1.00 μg/L处理。光合速率的提高需要消耗更多的CO2,胞间CO2浓度会随光合效率的提高而降低,PVE在0.05~0.50 μg/L浓度范围内胞间CO2浓度较CK显著降低9.3%~18.3%。研究同时发现PVE能够促进叶片气体交换,与CK相比,所有施用PVE的处理叶片气孔导度显著增加7.9%~16.2%。蒸腾作用是植物进行水分与养分吸收运移的主要动力,0.05、0.10、0.20和0.50 μg/L处理较CK分别提高了叶片蒸腾速率63.5%、63.5%、41.0%和34.0%,从而提高了水稻对水分/养分吸收和运移的能力。综合水稻叶片光合参数,PVE在0.10 μg/L浓度下具有最佳施用效果,但随着浓度的进一步提高施用效果逐渐下降,至1.00 μg/L时叶片光合速率和蒸腾速率与CK已无显著差异。
表 2 不同PVE浓度处理水稻叶片的光合特性Table 2. Photosynthetic characteristics of rice leaves under different PVE concentrationsPVE浓度 (μg/L)
PVE concentration光合速率[μmol/(m2·s)]
Photosynthetic rate气孔导度Gs
[mol/(m2·s)]胞间CO2浓度Ci
(μmol/mol)蒸腾速率Tr
[mmol/(m2·s)]0 (CK) 12.5 d 0.3886 c 170.6 a 5.2 c 0.05 16.3 a 0.4428 a 146.1 b 8.5 a 0.10 16.8 a 0.4514 a 139.4 c 8.5 a 0.20 14.4 c 0.4464 a 148.2 b 7.3 b 0.50 13.1 c 0.4253 b 154.8 b 6.9 b 1.00 12.7 d 0.4191 b 155.3 b 5.9 bc 注(Note):同列数值后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments (P < 0.05). 2.6 不同PVE浓度对水稻叶片及根系抗逆酶活性和丙二醛含量的影响
SOD和CAT是最有效的催化清除活性氧反应的酶。施用PVE的各处理叶片SOD活性较CK显著增加22.2%~46.9%,但根系中只有0.10 μg/L处理SOD活性显著高于CK28.0% (表3)。0.10 μg/L处理叶片和根系CAT活性还较CK显著提高9.5%和12.5%,但不同PVE施用浓度对叶片POD活性,根系SOD、CAT和POD活性影响不显著。活性氧会加速多聚不饱和脂肪酸降解产生MDA,对植物造成二次伤害。与CK相比,0.05 μg/L处理显著降低叶片和根系中MDA含量16.6%和24.6%,0.10 μg/L处理显著降低叶片和根系中MDA含量22.0%和29.8%。综合来看,低浓度的PVE能够提高抗逆酶活性,降低MDA含量,从而减少细胞损伤,提高水稻耐低温能力。
表 3 不同PVE浓度处理水稻叶片及根系抗逆酶活性及丙二醛含量Table 3. Stress-resistance enzyme activity and MDA content in rice leaves and roots under different PVE concentrations部位
OrganPVE浓度 (μg/L)
PVE concentrationMDA
(μmol/g, FW)SOD
(U/g, FW)CAT
[U/(g∙min), FW]POD
[U/(g∙min), FW]叶片Leaf 0 (CK) 60.9 a 197.0 d 7.60 bc 311.4 b 0.05 50.8 b 262.8 b 8.09 ab 341.6 ab 0.10 47.5 b 289.4 a 8.33 a 368.9 a 0.20 54.3 ab 275.5 ab 7.75 abc 333.2 ab 0.50 56.1 ab 261.0 bc 7.75 abc 344.6 ab 1.00 59.3 a 240.7 c 7.46 c 331.4 ab 根系Root 0 (CK) 30.2 a 153.8 b 2.52 b 270.8 b 0.05 22.8 b 195.4 ab 2.89 a 316.9 a 0.10 21.2 b 196.9 a 2.84 a 315.4 a 0.20 22.5 b 196.3 ab 2.85 a 284.4 ab 0.50 24.3 b 181.4 ab 2.75 ab 299.3 ab 1.00 28.1 a 179.4 ab 2.80 ab 288.1 ab 注(Note):同列数值后不同字母表示相同部位不同PVE浓度处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments for the same organ (P < 0.05). 3. 讨论
水稻遭受冷害时会发生光能转化效率降低[25]、叶绿素合成受到抑制[9]、丙二醛等代谢产物含量升高等生理变化[5],并伴随着种子发芽率降低[26]、幼苗生长缓慢等现象。因此增强作物对养分的吸收能力、保证作物体内生理生化及代谢反应的正常运行是生物刺激素调控胁迫耐受性的关键[27]。研究者发现生物刺激素能够调控植物代谢中的光合作用进程[28],并通过增加根系与土壤/营养液的接触与吸收面积促进植物对养分的吸收[17, 29]。类似试验结果也出现于本试验中,相较于CK,PVE在0.05~0.50 μg/L浓度范围内使水稻叶片的光合速率和蒸腾速率分别显著提升5.1%~34.4%和34.0%~63.5%,同时水稻根系更加发达,根系总长度、根表面积、根体积和根平均直径等指标也均显著提高,从而通过增加养分运输的动力以及根系与养分的接触面积两个途径提高了水稻幼苗对水分和养分的吸收能力。低温胁迫会导致水稻细胞内氧代谢失衡,由此产生的活性氧簇会引发膜脂过氧化并造成膜系统损伤[30-31],并进一步加速多聚不饱和脂肪酸降解产生MDA,从而对植物造成二次伤害[32]。朱云林等[12]和黄凤莲等[13]证实生物刺激素具有增强水稻幼苗体内抗氧化酶活性的能力。本试验条件下,施用PVE后水稻幼苗体内SOD和POD活性显著上升,保障了酶系统保护机制的正常运行,PVE进一步降低了叶片和根系中MDA含量16.6%~22.0%和24.6%~29.8%。因此,PVE通过增加根系养分吸收面积、提高叶片光合能力和减少细胞氧化损伤途径共同作用提高了对水稻幼苗对低温胁迫的耐受性。但与其他研究者的研究结果不同,供试PVE在0.05~0.10 μg/L的浓度下就能起到缓解低温胁迫的作用。而在其他研究报道中,生物刺激素因其来源和组分不同,其促进或抑制生长的浓度存在较大差异,但大致施用范围在50~1000 mg/L。PVE的最适抗逆浓度仅为常规生物刺激素的1/500000,甚至更低,因此可以认为PVE是一种高效的生物刺激素。
供试宛氏拟青霉来源于野生沙棘根系,并在一定的施用量下显著提高了水稻幼苗叶片和根系的重量,这可能是由于菌株提取物中的活性成分诱导植物产生了如生长素等多种内源激素,从而促进了水稻根系的生长和组织的分化,并在低温胁迫下通过影响内源激素水平的形式达到了稳定蛋白质并保护膜系统的作用[33]。但本试验条件下随着PVE施用浓度的提高,PVE缓解低温胁迫的能力反而逐渐减弱。且使用函数模型对0~0.20 μg/L范围内PVE浓度与水稻幼苗总重间的相互关系进行模拟时发现,随着PVE浓度的增加,水稻幼苗总重呈先增加后降低的趋势,低浓度的PVE增加了水稻幼苗干物质累积,但随着施用浓度的增加水稻幼苗的生长反而受到抑制。Selvi等[34]的研究也得出类似结果,过量的生物刺激素往往伴随着强烈的抑制作用。因此PVE在高浓度条件下可能干扰了水稻其他生理途径并抑制了水稻的生长,从而掩盖了其对水稻抵御低温胁迫的正面作用。
二叶期的水稻对低温环境极为敏感,也是抗性最弱的时期,持续低温会导致叶片黄化失绿,产生死苗、烂秧等症状[12],而随着水稻的生长,根系对水分及养分的吸收能力会逐渐增强,对低温的耐受性也会逐渐提高,PVE在水稻幼苗上施用后有较好的抗逆作用,推测该生物刺激素在水稻的整个生育时期内都有较好的施用效果。但在生物刺激素实际推广和应用的过程中,Ertani等[35]发现生物刺激素对施用剂量和施用方式要求严格,且由于其中的多种生物活性成分共同作用而难以阐明作用机理,因此难以实现稳定的商业化。PVE同样会因施用剂量低、施用阈值窄而极易出现施用不均、施用量过大等问题。为此,后续研究工作中需增加低浓度PVE处理的数量,便于更好地通过函数分析水稻的各项指标与PVE施用量的关系;探寻PVE抑制水稻生长的阈值及更科学的稀释方法,以便更合理地指导农业生产;增设恢复试验、正常温度对照,延长试验时间从水稻种植至收获,系统研究水稻在整个生命周期中的生理生化反应和养分吸收能力对PVE的响应。此外,针对不同作物,PVE的施用量和作用机制也需进一步探讨。
4. 结论
15℃低温胁迫条件下,PVE能够打破水稻种子休眠。PVE处理浓度为0.10 μg/L时,可显著增加水稻幼苗根系重量,提升叶片光合速率,提高叶片和根系抗氧化酶活性,并显著降低叶片和根系MDA含量,最终提高水稻地上部分生物量。
-
表 1 不同PVE浓度处理水稻根系形态
Table 1 Root morphology of rice under different PVE concentrations
PVE浓度 (μg/L)
PVE concentration总长度 (mm)
Total length投影面积 (mm2)
Projection area面积 (mm2)
Area表面积 (mm2)
Surface area根体积 (mm3)
Root volume平均直径 (mm)
Average diameter0 (CK) 192.5 c 12.8 d 10.9 c 44.9 c 1.22 d 0.36 c 0.05 265.6 ab 18.8 a 16.0 a 60.4 a 1.59 a 0.47 a 0.10 285.0 a 19.1 a 15.4 a 61.3 a 1.66 a 0.49 a 0.20 243.0 b 16.6 b 13.7 b 55.3 b 1.47 b 0.42 b 0.50 217.1 c 15.8 b 13.2 b 50.5 b 1.36 c 0.39 bc 1.00 208.4 c 14.7 c 13.1 b 45.1 c 1.31 cd 0.36 c 注(Note):同列数值后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments ( P < 0.05). 表 2 不同PVE浓度处理水稻叶片的光合特性
Table 2 Photosynthetic characteristics of rice leaves under different PVE concentrations
PVE浓度 (μg/L)
PVE concentration光合速率[μmol/(m2·s)]
Photosynthetic rate气孔导度Gs
[mol/(m2·s)]胞间CO2浓度Ci
(μmol/mol)蒸腾速率Tr
[mmol/(m2·s)]0 (CK) 12.5 d 0.3886 c 170.6 a 5.2 c 0.05 16.3 a 0.4428 a 146.1 b 8.5 a 0.10 16.8 a 0.4514 a 139.4 c 8.5 a 0.20 14.4 c 0.4464 a 148.2 b 7.3 b 0.50 13.1 c 0.4253 b 154.8 b 6.9 b 1.00 12.7 d 0.4191 b 155.3 b 5.9 bc 注(Note):同列数值后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments (P < 0.05). 表 3 不同PVE浓度处理水稻叶片及根系抗逆酶活性及丙二醛含量
Table 3 Stress-resistance enzyme activity and MDA content in rice leaves and roots under different PVE concentrations
部位
OrganPVE浓度 (μg/L)
PVE concentrationMDA
(μmol/g, FW)SOD
(U/g, FW)CAT
[U/(g∙min), FW]POD
[U/(g∙min), FW]叶片Leaf 0 (CK) 60.9 a 197.0 d 7.60 bc 311.4 b 0.05 50.8 b 262.8 b 8.09 ab 341.6 ab 0.10 47.5 b 289.4 a 8.33 a 368.9 a 0.20 54.3 ab 275.5 ab 7.75 abc 333.2 ab 0.50 56.1 ab 261.0 bc 7.75 abc 344.6 ab 1.00 59.3 a 240.7 c 7.46 c 331.4 ab 根系Root 0 (CK) 30.2 a 153.8 b 2.52 b 270.8 b 0.05 22.8 b 195.4 ab 2.89 a 316.9 a 0.10 21.2 b 196.9 a 2.84 a 315.4 a 0.20 22.5 b 196.3 ab 2.85 a 284.4 ab 0.50 24.3 b 181.4 ab 2.75 ab 299.3 ab 1.00 28.1 a 179.4 ab 2.80 ab 288.1 ab 注(Note):同列数值后不同字母表示相同部位不同PVE浓度处理间差异显著 (P < 0.05) Values followed by different letters in a column indicate significant difference among treatments for the same organ (P < 0.05). -
[1] 马树庆, 刘晓航, 邓奎才, 等. 幼穗形成期低温对水稻结实的影响[J]. 应用生态学报, 2018, 29(1): 125-132. Ma S Q, Liu X H, Deng K C, et al. Impact of low temperature in young ear formation stage on rice seed setting[J]. Chinese Journal of Applied Ecology, 2018, 29(1): 125-132.
[2] Mariani L, Parisi S G, Cola G. Space and time behavior of climatic hazard of low temperature for single rice crop in the mid latitude[J]. International Journal of Climatology, 2010, 29(12): 1862-1871.
[3] 王艳华, 任传友, 韩亚东, 等. 东北地区活动积温和极端持续低温的时空分布特征及其对粮食产量的影响[J]. 农业环境科学学报, 2011, 30(9): 1742-1748. Wang Y H, Ren C Y, Han Y D, et al. The Tempo-spatial patterns of active accumulated and consecutive extreme low temperature and their impacts on grain crop yield in northeast China[J]. Journal of Agro-Environment Science, 2011, 30(9): 1742-1748.
[4] Oliver S N, Van Dongen J T, Alfred S C, et al. Cold-induced repression of the rice anther-specific cell wall invertase gene OSINV4, is correlated with sucrose accumulation and pollen sterility[J]. Plant Cell and Environment, 2005, 28(12): 1534-1551. DOI: 10.1111/j.1365-3040.2005.01390.x
[5] Zhang Q, Chen Q, Wang S, et al. Rice and cold stress: methods for its evaluation and summary of cold tolerance-related quantitative trait loci[J]. Rice, 2014, 7(1): 1-12. DOI: 10.1186/1939-8433-7-1
[6] 王春萍, 雷开荣, 李正国, 等. 低温胁迫对水稻幼苗不同叶龄叶片叶绿素荧光特性的影响[J]. 植物资源与环境学报, 2012, 21(3): 38-43. DOI: 10.3969/j.issn.1674-7895.2012.03.006 Wang C P, Lei K R, Li Z G, et al. Effect of chilling stress on chlorophyll fluorescence characteristics of seeding leaves with different leaf ages of Oryza sativ[J]. Journal of Plant Resources and Environment, 2012, 21(3): 38-43. DOI: 10.3969/j.issn.1674-7895.2012.03.006
[7] 王冰, 程宪国. 干旱、高盐及低温胁迫下植物生理及转录因子的应答调控[J]. 植物营养与肥料学报, 2017, 23(6): 1565-1574. DOI: 10.11674/zwyf.17312 Wang B, Cheng X G. Physiological responses and regulatory pathways of transcription factors in plants under drought, high-salt, and low temperature stresses[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(6): 1565-1574. DOI: 10.11674/zwyf.17312
[8] Król A, Amarowicz R, Weidner S. The effects of cold stress on the phenolic compounds and antioxidant capacity of grapevine (Vitis vinifera L.) leaves[J]. Journal of Plant Physiology, 2015, 189: 97-104. DOI: 10.1016/j.jplph.2015.10.002
[9] Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions[J]. Plant Physiology, 2006, 141(2): 391-396. DOI: 10.1104/pp.106.082040
[10] Los D A, Murata N. Membrane fluidity and its roles in the perception of environmental signals[J]. Biochimica et Biophysica Acta, 2004, 1666(1-2): 142-157. DOI: 10.1016/j.bbamem.2004.08.002
[11] 王国莉, 郭振飞. 低温对水稻不同耐冷品种幼苗光合速率和叶绿素荧光参数的影响[J]. 中国水稻科学, 2005, 19(4): 381-383. DOI: 10.3321/j.issn:1001-7216.2005.04.018 Wang G L, Guo Z F. Effects of chilling stress on photosynthetic rate and the parameters of chlorophyll fluorescence in two rice varieties differing in sensitivity[J]. Chinese Journal of Rice Science, 2005, 19(4): 381-383. DOI: 10.3321/j.issn:1001-7216.2005.04.018
[12] 朱云林, 顾大路, 王伟中, 等. 壳聚糖对水稻幼苗抗冷性的影响[J]. 江苏农业科学, 2017, 45(8): 66-68. Zhu Y L, Gu D L, Wang W Z, et al. Effects of chitosan on cold resistance of rice seedlings[J]. Jiangsu Agricultural Sciences, 2017, 45(8): 66-68.
[13] 黄凤莲, 戴良英, 罗宽, 等. 药剂诱导水稻幼苗抗寒机制研究[J]. 作物学报, 2000, 26(1): 92-97. DOI: 10.3321/j.issn:0496-3490.2000.01.021 Huang F L, Dai L Y, Luo K, et al. Mechanism studies on pharmaceutical induction for resistance to cold of rice seedlings[J]. Acta Agronomica Sinica, 2000, 26(1): 92-97. DOI: 10.3321/j.issn:0496-3490.2000.01.021
[14] Brown P, Saa S. Biostimulants in agriculture[J]. Frontiers in Plant Science, 2015, 6(671): 1-3.
[15] Calvo P, Nelson L, Kloepper J W. Agricultural uses of plant biostimulants[J]. Plant and Soil, 2014, 383(1-2): 3-41. DOI: 10.1007/s11104-014-2131-8
[16] 孙磊, 陈国祥, 程嘉翎, 等. 低聚壳聚糖处理对低温胁迫下水稻幼苗类囊体膜特性的影响[J]. 南京师大学报(自然科学版), 2009, 32(2): 93-97. Sun L, Chen G X, Cheng J L, et al. Effects of chitosan treatment on thylakoid membrane characteristics in rice seedling under low temperature[J]. Journal of Nanjing Normal University (Natural Science Edition), 2009, 32(2): 93-97.
[17] 张水勤, 袁亮, 林治安, 等. 腐植酸促进植物生长的机理研究进展[J]. 植物营养与肥料学报, 2017, 23(4): 1065-1076. DOI: 10.11674/zwyf.16255 Zhang S Q, Yuan L, Lin Z A, et al. Advances in humic acid for promoting plant growth and its mechanism[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(4): 1065-1076. DOI: 10.11674/zwyf.16255
[18] 邓如福, 裴炎, 王瑜宁, 等. 海藻糖对水稻幼苗抗寒性研究[J]. 西南大学学报(自然科学版), 1991(3): 347-350. Deng F R, Pei Y, Wang Y N, et al. A study on trehalose treatment as related to chilling-resistance in rice seedlings[J]. Journal of Southwest Agriculture University (Natural Science Edition), 1991(3): 347-350.
[19] Nardi S, Pizzeghello D, Schiavon M, et al. Plant biostimulants: physiological responses induced by protein hydrolyzed-based products and humic substances in plant metabolism[J]. Scientia Agricola, 2016, 73(1): 18-23. DOI: 10.1590/0103-9016-2015-0006
[20] 王浩, 杨方社, 李怀恩, 等. 沙棘柔性坝对砒砂岩沟道泥沙粒径分布及有机质影响[J]. 水土保持学报, 2017, 31(5): 158-163. Wang H, Yang F S, Li H E, et al. Effects of seabuckthorn flexible dam on sediment particle size distribution and organic matter in the soft sandstone gully[J]. Journal of Soil and Water Conservation, 2017, 31(5): 158-163.
[21] 刘文祥, 李勇, 于寒青. 草灌植被恢复提高坡地土壤水稳性团聚体和碳、氮含量的有效性: 退耕年限的影响[J]. 植物营养与肥料学报, 2016, 22(1): 164-170. DOI: 10.11674/zwyf.14598 Liu W X, Li Y, Yu H Q. Soil water stable aggregates and carbon and nitrogen storage enhanced by conversion of farmland to shrub and grass in China Loess Plateau: the influence of conversion cultivation time[J]. Journal of Plant Nutrition and Fertilizers, 2016, 22(1): 164-170. DOI: 10.11674/zwyf.14598
[22] 山东蓬勃生物科技有限公司. 一种宛氏拟青霉菌株SJ1及其应用[P]. 中国专利: 201510059660.1, 2015-02-05. Shandong Pengbo Biology Technology LTD. Co.. Application for Paecilomyces Variotii of SJ1[P]. China Patent: 201510059660.1, 2015-02-05.
[23] 武爱莲, 郭珺, 丁玉川, 等. Bacillus amyloliquefaciens Pb-4对穴盘育苗番茄生长及生理特性的影响[J]. 植物营养与肥料学报, 2018, 24(3): 841-848. DOI: 10.11674/zwyf.17128 Wu A L, Guo J, Ding Y C, et al. Effects of Bacillus amyloliquefaciens Pb-4 on growth and physiological characteristics of tomato under the condition of plug seeding[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(3): 841-848. DOI: 10.11674/zwyf.17128
[24] 张淑英, 褚贵新, 梁永超. 不同铵硝配比对低温胁迫棉花幼苗生长及抗氧化酶活性的影响[J]. 植物营养与肥料学报, 2017, 23(3): 721-729. DOI: 10.11674/zwyf.16397 Zhang S Y, Chu X G, Liang Y C. Impacts of different ammonium/nitrate ratios on the growth and antioxidantdefense enzyme activities in cotton seedlings exposed to low-temperature stress[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(3): 721-729. DOI: 10.11674/zwyf.16397
[25] Jeong S W, Choi S M, Lee D S, et al. Differential susceptibility of photosynthesis to light-chilling stress in rice (Oryza sativa L.) depends on the capacity for photochemical dissipation of light[J]. Molecules and Cells, 2002, 13(3): 419-428.
[26] 江玲, 侯名语, 刘世家, 等. 水稻种子低温萌发生理机制的初步研究[J]. 中国农业科学, 2005, 38(3): 480-485. DOI: 10.3321/j.issn:0578-1752.2005.03.008 Jiang L, Hou M Y, Liu S J, et al. Physiological mechanism of seed germination (Oryza sativa L) under low temperature[J]. Scientia Agriculture Sinica, 2005, 38(3): 480-485. DOI: 10.3321/j.issn:0578-1752.2005.03.008
[27] 徐国伟, 陆大克, 王贺正, 等. 干湿交替灌溉与施氮量对水稻叶片光合性状的耦合效应[J]. 植物营养与肥料学报, 2017, 23(5): 1225-1237. DOI: 10.11674/zwyf.17067 Xu G W, Lu D K, Wang H Z, et al. Coupling effect of wetting and drying alternative irrigation and nitrogen application rate on photosynthetic characteristics of rice leaves[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(5): 1225-1237. DOI: 10.11674/zwyf.17067
[28] 张运红, 孙克刚, 杜君, 等. 海藻寡糖增效尿素对水稻光合特性及碳代谢产物积累的影响[J]. 中国土壤与肥料, 2016, (3): 54-59. DOI: 10.11838/sfsc.20160309 Zhang Y H, Sun K G, Du J, et al. Effects of alginate-derived oligosaccharides synergistic urea on the photosynthetic characteristics and accumulation of carbon metabolites in rice[J]. Soil and Fertilizer Sciences in China, 2016, (3): 54-59. DOI: 10.11838/sfsc.20160309
[29] Eyheraguibel B, Silvestre J, Morard P. Effects of humic substances derived from organic waste enhancement on the growth and mineral nutrition of maize[J]. Bioresource Technology, 2008, 99(10): 4206-4212. DOI: 10.1016/j.biortech.2007.08.082
[30] Mittal D, Madhyastha D A, Grover A. Genome-Wide transcriptional profiles during temperature and oxidative stress reveal coordinated expression patterns and overlapping regulons in rice[J]. PloS ONE, 2012, 7(7): e40899. DOI: 10.1371/journal.pone.0040899
[31] Bonnecarrère V, Borsani O, Díaz P, et al. Response to photoxidative stress induced by cold in japonica rice is genotype dependent[J]. Plant Science, 2011, 180(5): 726-732. DOI: 10.1016/j.plantsci.2011.01.023
[32] Pamplona R. Advanced lipoxidation end-products[J]. Chemico-Biological Interactions, 2011, 192(1): 14-20.
[33] 秦娟娟, 闫淑珍, 刘佳. 植物内生细菌固体菌剂对辣椒的促生和防病作用[J]. 植物保护学报, 2010, 37(4): 325-330. Qin J J, Yan S Z, Liu J. The growth-promotion on pepper and control of phytophthora capsici by endophytic bacterium agents[J]. Journal of Plant Protection, 2010, 37(4): 325-330.
[34] Selvi Y, Atli A, Besiroglu L, et al. A gain-of-function mutation in an Arabidopsis Toll Interleukin1 receptor-nucleotide binding site-leucine-rich repeat type R gene triggers defense responses and results in enhanced disease resistance[J]. Plant Cell, 2002, 14(12): 3149-3162. DOI: 10.1105/tpc.005348
[35] Ertani A, Francioso O, Tugnoli V, et al. Effect of commercial lignosulfonate-humate on Zea mays L. metabolism[J]. Journal of Agricultural and Food Chemistry, 2011, 59(22): 11940-11948. DOI: 10.1021/jf202473e



 下载:
下载: