Allelopathic effects of ferulic acid inducing Fusarium wilt occurrence and abnormal root tissue structure of faba bean
-
摘要:目的
酚酸类化合物是多种农作物根际土壤中常见的自毒物质,化感自毒物质与土传病害发生密切相关。研究阿魏酸对枯萎病发生的促进效应及机理,为阐明连作自毒物质–病原菌–寄主抗病性互作效应提供参考。
方法采用水培试验研究阿魏酸对蚕豆幼苗生长和枯萎病发生的影响。在蚕豆幼苗长至4~6片真叶时,将其移入2 L Hoagland 营养液中进行培养,其中阿魏酸浓度分别为0、50、100、200 mg/L。待阿魏酸处理2 天后,加入25 mL 1 × 106 cfu/mL的尖孢镰刀菌孢子悬浮液。继续培养40天后,取样调查植株生长状况和枯萎病发病率。利用显微镜观察蚕豆根系细胞组织结构的变化,通过室内培养试验研究尖孢镰刀菌菌丝生长和致病力对阿魏酸胁迫的响应。
结果与无添加阿魏酸 (0 mg/L) 处理相比,添加阿魏酸处理显著抑制蚕豆幼苗的生长,且阿魏酸浓度越高抑制作用越强。本试验条件下,阿魏酸处理显著提高蚕豆枯萎病发病率300.0%~500.0%,显著增加病情指数113.3%~1666.7%,发病率和病情指数均在阿魏酸处理浓度200 mg/L下达到最大值。阿魏酸处理抑制尖孢镰刀菌的菌丝生长,显著提高尖孢镰刀菌产生的果胶酶、纤维素酶、淀粉酶和蛋白酶活性44.8%~59.0%、78.2%~145.6%、975.6%~2435.4%和165.1%~622.9%;显著提高枯萎酸含量107.6%~236.2%。阿魏酸胁迫下,蚕豆根系表皮细胞扭曲变形,木质部导管变细,导管壁增厚,胶状物和内含物充满整个细胞,阻碍营养物质和水分的正常运输,进而加速蚕豆枯萎死亡。
结论阿魏酸胁迫虽然抑制尖孢镰刀菌的菌丝生长,但显著提高蚕豆根系细胞壁降解酶活性和枯萎酸含量,进而增加尖孢镰刀菌致病力,加速根系细胞组织结构损伤,促进尖孢镰刀菌侵入蚕豆根系,加剧枯萎病发生和危害。阿魏酸在蚕豆连作障碍中扮演着初始诱因的角色。
Abstract:ObjectivesPhenolic acid compounds are common autotoxin in rhizosphere soils of crops, and the allelopathic autotoxins play a key role in soil sickness and soil-borne disease. The aim of this study was to evaluate the role of ferulic acid (FA) in Fusarium oxysporum f. sp. fabae (FOF)-infected faba bean roots, reveal the mechanism of continuous autotoxins promoting the occurrence of soil-borne diseases.
MethodsEffects of ferulic acid on the growth of faba bean seeding and Fusarium wilt occurrence were studied using hydroponics method. Faba bean seedlings of 4–6 open leaves were cultured in 2 L Hoagland nutrient solution with ferulic acid concentrations of 0, 50, 100 and 200 mg/L, respectively. After 2 days’ culture, 25 mL of FOF suspension (1 × 106 cfu/mL) were incubated into the solution. Continuously cultured for another 40 days, faba bean samples were collected for investigation of faba bean growth and Fusarium wilt incidence. Faba bean roots tissue structure changes were observed using microscope. The effects of FA on growth and pathogenicity of FOF in vivo were also examined.
ResultsCompared to the 0 mg/L, the FA treatment significantly reduced the growth of faba bean seedlings, the higher the treatment concentration, the stronger the inhibition; in addition, FA treatments increased the incidences of Fusarium wilt by 300.0%–500.0% and the disease index by 113.3%–1666.7%, with the maxima at FA concentration of 200 mg/L. The FA inhibited the mycelium growth of FOF, but significantly increased the activities of pectinase, cellulase, amylase and protease secreted by FOF, with increase ranges of 44.8%–59.0%, 78.2%–145.6%, 975.6%–2435.4% and 165.1%–622.9%, respectively, and significantly stimulated fusaric acid secretion of FOF by 107.6%–236.2%. Under FA stress, the epidermal cells of faba bean roots were distorted, the xylem vessels became thinner, and the duct wall thickened. The whole cells were fully filled with jelly and inclusions, hindering the normal transportation of nutrients and water, thus accelerating the death of the faba beans.
ConclusionsFA inhibits the growth of FOF, but stimulates the mycotoxin production and the activities of pathogenesis-related hydrolytic enzymes (pectinase, cellulase, amylase and protease), which is related to the damage of root tissue structure and benefit the invasion of FOF, and accelerate the incidence of Fusarium wilt consequently. Therefore, FA could be involved in plant–pathogen allelopathy as a stimulator.
-
蚕豆是重要的食用豆类作物之一,富含蛋白质,作为粮食、蔬菜和饲料在世界各国广泛种植。中国是世界上蚕豆种植面积最大、总产量最高的国家,干蚕豆产量占世界总产的36.7%[1]。蚕豆是典型的忌连作作物,近年来随着蚕豆生产的不断发展,主产区的连作障碍非常普遍且日益严重,造成蚕豆生长矮小、瘦弱、病害加重、结荚少、产量低,已成为制约我国蚕豆可持续发展的重要因子[2]。引起蚕豆连作障碍的原因有很多种,但最主要的还是土壤中病原物积累而导致的土传枯萎病加重,该病在中国蚕豆主产区非常普遍,云南为枯萎病发生最严重的省份[2]。
蚕豆枯萎病由尖孢镰刀菌蚕豆专化型 (Fuarium oxysporum f. sp. fabae,FOF) 病菌侵染,造成根系腐烂、茎基部坏死直至植株萎蔫死亡[3]。蚕豆枯萎病发生是FOF致病因子及蚕豆防御反应相互斗争的结果。FOF趋化生长附着根表面,穿过根部细胞壁并定居于根皮层,通过堵塞寄主作物维管束组织或分泌毒素等导致寄主发病严重[4]。FOF的致病能力与多种致病因子相关,其中细胞壁降解酶 (cell wall degrading enzymes,CWDEs) 和毒素是其重要致病因子,且在病原菌侵染过程中协同作用[5]。
酚酸类化合物是多种农作物根系土壤中常见的自毒物质,由其导致的自毒作用日益制约着现代农业增产增收[6]。尽管土传枯萎病的严重发生是蚕豆连作障碍发生的直接原因,但化感自毒物质绝非简单的辅助因素。姜伟涛等[7]的研究表明,串珠镰孢菌和根皮苷组合处理显著抑制了‘平邑甜茶’幼苗的生长,说明根皮苷和串珠镰孢菌共同作用加重了苹果连作障碍现象。自毒物质不仅影响病菌生长和孢子萌发,而且还在作物根部与病原菌的互作中扮演着重要的角色,被认为是导致作物连作障碍发生的主导因素[8]。Wu等[9-10]的研究表明,黄瓜连作自毒物质肉桂酸、苯甲酸等不但能促进尖孢镰刀菌生长,而且在尖孢镰刀菌培养基中加入肉桂酸、苯甲酸等后,毒素 (镰刀菌酸) 产量增加,果胶酶、纤维素酶、淀粉酶等细胞壁降解酶活性也相应增强。表明自毒物质促进病原菌产生细胞壁降解酶及毒素可能是其促使土传病严重发生的重要途径。同时连作化感自毒物质还进一步破坏植物细胞,干扰植物自身的生理生化及防卫系统,破坏植物对病原菌的抵御能力,加重连作障碍的发生[11]。如用三七连作自毒物质Rg1处理三七根系后,根系细胞变形、细胞壁增厚,根系中细胞壁主要组成成分 (纤维素和果胶) 降解,导致细胞结构被破坏,从而促进根腐病菌的侵染[11]。
云南农业大学资源与环境学院间套作与病害控制课题组在前期田间试验中发现,蚕豆连作导致土传枯萎病严重发生,同时在连作根际土壤中检测到7种酚酸类化感物质 (对羟基苯甲酸、香草酸、丁香酸、阿魏酸、苯甲酸、水杨酸和肉桂酸),其中阿魏酸是含量较高的主要化感物质之一[12]。然而,在阿魏酸和FOF共同存在条件下,阿魏酸对FOF生长及其致病力的化感效应还未见报道,有关蚕豆根系组织结构对阿魏酸和FOF双重胁迫的响应尚不清楚。因此,本研究通过室内培养实验,研究阿魏酸对FOF生长、产酶和产毒的影响,通过盆栽水培试验探讨蚕豆根系组织结构变化与枯萎病发生的关系,旨在揭示化感自毒物质在蚕豆连作障碍形成中的作用机理。
1. 材料与方法
1.1 试验材料
供试蚕豆 (Vicia faba L.) 品种为‘89–147’,购于云南省农业科学院。
尖孢镰刀菌蚕豆专化型 (FOF),由云南农业大学资源与环境学院土壤微生物实验室从蚕豆连作土壤中筛选并保存。在马铃薯葡萄糖琼脂培养基[13](PDA) 上培养,于28℃培养箱中恒温培养7天后,将PDA上培养7天的尖孢镰刀菌菌落用无菌水冲洗,经4层纱布过滤收集孢子并稀释成浓度为 ≤ 1 × 106 cfu/mL的孢子悬液。
1.2 试验设计
阿魏酸处理设4个外源添加浓度 (0、50、100、200 mg/L),以0 mg/L为对照,使用等量的Hoagland营养液[13]代替,每个处理4次重复,共计16盆。
盆栽试验于2018年10月至12月在云南农业大学资源与环境学院温室大棚内进行。挑选大小一致,种皮完整的蚕豆种子,用10%的H2O2浸泡30 min,再用去离子水清洗干净,置于25℃恒温培养箱中,发芽后播种在Hoagland营养液浸透的无菌石英砂中培养。当蚕豆幼苗长至4~6片真叶时,将其移入2 L Hoagland营养液中进行水培,其中阿魏酸浓度分别为0、50、100、200 mg/L。每盆种植6株蚕豆,24 h通气泵通气。待阿魏酸处理2天后,在该水培容器中加入25 mL 1 × 106 cfu/mL的尖孢镰刀菌孢子悬浮液。每周更换新的Hoagland营养液和阿魏酸溶液。
1.3 蚕豆幼苗生长参数测定和枯萎病调查
蚕豆幼苗经阿魏酸处理40天后,每个重复取3株长势一致的蚕豆植株测定叶片数、最大叶长、最大叶宽、株高、主根长、地上部干重和根干重,最终计算平均值。在测定蚕豆幼苗生长参数的同时调查枯萎病发生情况,每处理调查4盆,每盆调查6株,每处理调查24株。按5级分类标准进行枯萎病调查并计算发病率和病情指数[13]。
发病率=发病株数/调查总株数 × 100%
病情指数=Σ(各级病株数 × 相应级值)/(最高级值 × 调查总株数) × 100
1.4 尖孢镰刀菌菌丝测定
在PDA培养基中分别加入阿魏酸使终浓度为0、50、100、200 mg/L,倒入8.5 cm培养皿冷却。用直径0.9 cm的打孔器打取生长一致、培养基厚度均匀的等龄尖孢镰刀菌菌饼接种至培养皿中心,28℃培养6天,于2~6天采用十字交叉法测量菌落直径大小,每个处理重复3次,最终取平均值。各处理组对尖孢镰刀菌的化感效应用化感效应指数[14](RI) 表示,用C表示对照值、T表示处理值。当T ≥ C时,RI = 1 − C/T;当T < C时,RI = T/C –1。当RI > 0时,表现为促进作用;当RI < 0时,表现为抑制作用。
1.5 尖孢镰刀菌细胞壁降解酶制备与酶活性测定
产酶培养基:使用PDA合成培养基并添加1%的诱导底物 (果胶、纤维素、可溶性淀粉、酪蛋白) 制备产酶培养基。将25 mL产酶培养基加入100 mL烧瓶中,接种直径9 mm菌龄7天的菌块,并在28℃、200 r/min环境下培养7天。将收集的培养液以4000 r/min离心10min,取上清液,使用孔径为0.45 μm滤膜过滤,得到的滤液即为粗提液,将其保存在4℃下待测。
果胶酶、纤维素酶、淀粉酶活性测定参照曹春蕾等[15]的方法进行。果胶酶以1 min被水解生成1 μmol半乳糖醛酸量定义为1个酶活性单位;纤维素酶以1 min产生1 μmol葡萄糖所需要的酶量定义为1个酶活性单位;淀粉酶以1 min释放1 μmol葡萄糖所需要的酶量定义为1个酶活性单位。蛋白酶活性测定参照陈钰泉等[16]的方法进行:1个酶活性单位定义为1 min水解酪蛋白产生1 μg酪氨酸需要的酶量。
1.6 尖孢镰刀菌毒素(枯萎酸)提取和测定
产毒培养基采用改良Richard液体培养基配方[17]配制。将125 mL培养液倒入250 mL三角瓶,接种直径9 mm的7天龄菌块,每瓶接8片,并在28℃、180 r/min环境下培养15天。收集的培养液5000 r/min离心10 min后取上清液,使用孔径为0.45 μm的滤膜过滤,将上清液在 ≤ 40℃干燥压缩后加入等体积乙酸乙酯,震荡2 min,室温下放置沉淀30 min,将收集的有机相在4000 r/min离心10 min,于40℃干燥上清液,后将干燥物于5 mL乙酸乙酯中溶解,在269 nm测定吸光度,每个处理重复3次,取平均值。
1.7 蚕豆根部切片的制备和观察
阿魏酸处理40天后进行采样,采样时将蚕豆根部在流水下冲洗干净,自根尖起每隔1~2 cm取样,取样长度约5 mm。按王宁等[18]的方法制作石蜡切片,依次将切片放入二甲苯Ⅰ 20 min,二甲苯Ⅱ 20 min,无水乙醇Ⅰ 5 min,无水乙醇Ⅱ 5 min,75%酒精5 min后,用自来水进行冲洗,再放入番红染液1~2 h。自来水稍洗,去掉多余染料,50%、70%、80%梯度酒精进行脱色,再放入固绿染液中30~60 s,无水乙醇三缸浸洗、脱水,最后将切片放入正丁醇、二甲苯透明5 min,将切片从二甲苯中拿出来稍晾干,进行中性树胶封片后,用显微镜 (Nikon Eclipse CI) 进行观察。
1.8 数据处理
采用WPS 2019软件进行数据处理,用SPSS 20.0软件邓肯法进行单因素方差分析 (P < 0.05)。
2. 结果与分析
2.1 阿魏酸处理对蚕豆幼苗生长和枯萎病发生的影响
2.1.1 阿魏酸处理对蚕豆幼苗生长的影响
如表1所示,阿魏酸不同浓度处理对蚕豆幼苗生长具有显著影响 (P < 0.05)。随处理浓度增加,蚕豆幼苗生长参数 (单株叶片数、最大叶长、最大叶宽、株高等) 均显著降低。与对照 (0 mg/L) 相比,50、100、200 mg/L阿魏酸处理显著降低蚕豆幼苗最大叶长22.0%、25.9%和30.1%,平均降低26.0%;显著降低最大叶宽22.1%、27.7%和39.5%,平均降低29.7%;显著降低主根长11.3%、16.6%和21.6%,平均降低16.5%;显著降低根干重9.8%、21.1%和41.4%,平均降低24.1%。阿魏酸100和200 mg/L浓度处理显著降低蚕豆幼苗株高11.8%和23.9%,显著降低根冠比22.7%和38.6%;50 mg/L处理对株高和根冠比无显著性影响。200 mg/L阿魏酸处理显著降低单株叶片数14.5%,而50和100 mg/L处理对单株叶片数均无显著影响。这表明阿魏酸处理对蚕豆幼苗各生长参数均存在不同程度的抑制作用,且阿魏酸浓度越高,抑制效应越强。
表 1 不同浓度阿魏酸处理对蚕豆幼苗生长的影响Table 1. Effects of different ferulic acid concentrations on the growth of faba bean seeding阿魏酸浓度
Ferulic acid concentration
(mg/L)单株叶片数
Leaf number
per plant最大叶长
Max. leaf
length
(cm)最大叶宽
Max. leaf
width
(cm)株高
Height
(cm)主根长
Main root length
(cm)地上部干重Shoot dry weight (g) 根干重
Root dry weight
(g)根冠比Root/shoot ratio 0 18.4 ± 0.2 a 6.1 ± 0.1 a 3.9 ± 0.1 a 37.9 ± 0.9 a 14.0 ± 0.9 a 1.0 ± 0.1 a 0.4 ± 0.0 a 0.4 ± 0.0 a 50 17.5 ± 1.4 a 4.8 ± 0.1 b 3.1 ± 0.2 b 37.3 ± 1.2 a 12.4 ± 0.5 b 1.0 ± 0.1 a 0.4 ± 0.0 b 0.4 ± 0.0 a 100 17.3 ± 0.6 ab 4.6 ± 0.1 bc 2.8 ± 0.1 c 33.4 ± 1.6 b 11.6 ± 1.1 b 1.0 ± 0.1 a 0.4 ± 0.0 c 0.3 ± 0.0 b 200 15.7 ± 0.6 b 4.3 ± 0.3 c 2.4 ± 0.0 d 28.8 ± 1.4 c 10.9 ± 0.5 b 1.0 ± 0.0 a 0.3 ± 0.0 d 0.3 ± 0.0 c 注(Note):数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). 2.1.2 阿魏酸处理对蚕豆枯萎病发生的影响
从表2可知,随阿魏酸浓度增加,蚕豆枯萎病发病率和病情指数均显著增加 (P < 0.05)。与对照 (0 mg/L) 相比,100和200 mg/L浓度处理显著增加发病率300.0%和500.0%,而50 mg/L浓度阿魏酸处理对发病率无显著影响。50、100和200 mg/L浓度处理显著增加病情指数113.3%、566.7%和1666.7%,表明阿魏酸胁迫加剧蚕豆枯萎病的发生,且阿魏酸处理浓度越高,发病越严重。
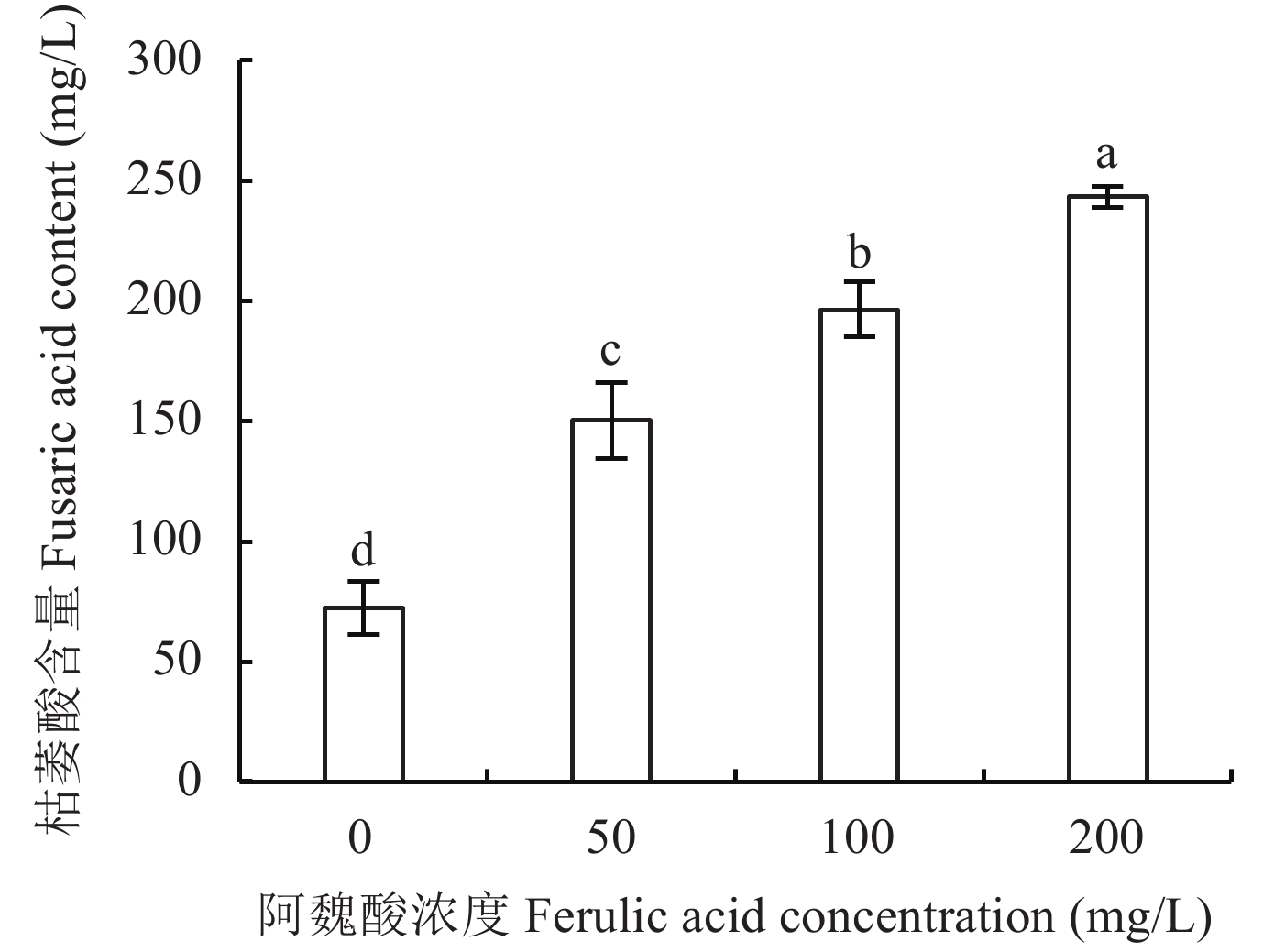
![]() 图 2 不同浓度阿魏酸处理尖孢镰刀菌分泌的枯萎酸含量[注(Note):柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars mean significant difference among treatments (P < 0.05).]Figure 2. The contents of fusaric acid secreted by Fusarium oxysporum f. sp. fabae affected by different ferulic acid concentrations in liquid culture
图 2 不同浓度阿魏酸处理尖孢镰刀菌分泌的枯萎酸含量[注(Note):柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars mean significant difference among treatments (P < 0.05).]Figure 2. The contents of fusaric acid secreted by Fusarium oxysporum f. sp. fabae affected by different ferulic acid concentrations in liquid culture2.2 阿魏酸对尖孢镰刀菌菌丝生长的影响
表3显示,与对照 (0 mg/L) 相比,50、100和200 mg/L阿魏酸处理显著降低菌落直径18.3%~22.9% (2天)、22.6%~26.7% (3天)、8.4%~13.1% (4天)、10.7%~13.6% (5天)、16.1%~20.5% (6天),且各培养天数内化感指数 (RI) 均为负值,阿魏酸浓度200 mg/L处理的抑制效果最强。说明阿魏酸抑制尖孢镰刀菌菌丝生长,且随其浓度和处理时间的增加,抑制效果越明显。
表 3 不同阿魏酸处理浓度下不同培养天数尖孢镰刀菌落直径和化感指数Table 3. Colony diameter and response index of Fusarium oxysporum f. sp. fabae affected by different ferulic acidconcentrations in different incubation days阿魏酸浓度
Ferulic acid concentration
(mg/L)2 d 3 d 4 d 5 d 6 d CD (mm) RI CD (mm) RI CD (mm) RI CD (mm) RI CD (mm) RI 0 4.9 ± 0.4 a 6.4 ± 0.3 a 6.3 ± 0.2 a 6.8 ± 0.3 a 7.6 ± 0.3 a 50 4.0 ± 0.1 b –0.2 ± 0.1 a 4.9 ± 0.1 b –0.2 ± 0.1 a 5.8 ± 0.1 b –0.1 ± 0.0 a 6.1 ± 0.1 b –0.1 ± 0.0 a 6.4 ± 0.1 b –0.2 ± 0.0 a 100 3.9 ± 0.2 b –0.2 ± 0.1 a 4.8 ± 0.1 b –0.2 ± 0.0 a 5.5 ± 0.1 c –0.1 ± 0.0 a 5.9 ± 0.1 b –0.1 ± 0.0 a 6.2 ± 0.1 bc –0.2 ± 0.0 a 200 3.8 ± 0.1 b –0.2 ± 0.1 a 4.7 ± 0.1 b –0.3 ± 0.0 a 5.5 ± 0.1 c –0.1 ± 0.0 a 5.9 ± 0.1 b –0.1 ± 0.0 a 6.1 ± 0.1 c –0.2 ± 0.0 a 注(Note):CD—菌落直径 Colony diameter; RI—化感指数 Response index. 数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). 2.3 阿魏酸对尖孢镰刀菌致病力的影响
2.3.1 阿魏酸对尖孢镰刀菌产酶的影响
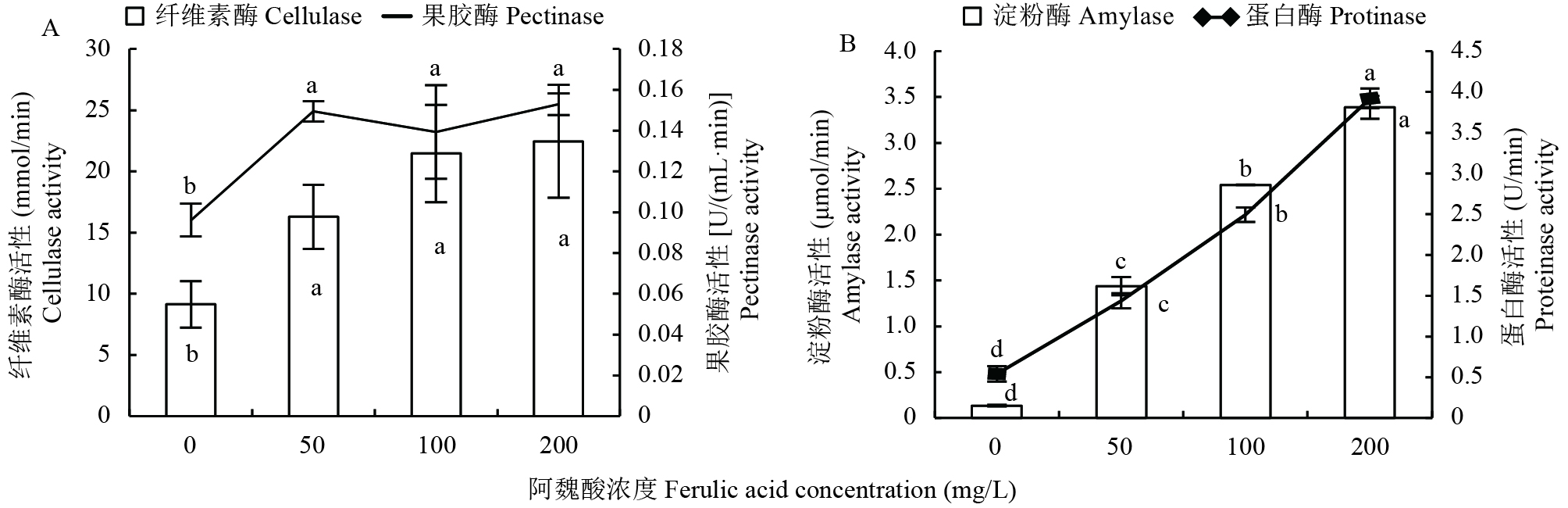
随阿魏酸处理浓度增加,细胞壁水解酶活性均显著增加 (P < 0.05)。与对照 (0 mg/L) 相比,50、100和200 mg/L阿魏酸处理果胶酶活性分别显著增加55.4%、44.8%和59.0%,平均增加53.0%;纤维素酶活性分别显著增加78.2%、134.9%和145.6%,平均增加119.6%;淀粉酶活性分别显著增加975.6%、1802.3%和2435.4%,平均增加1737.8%;蛋白酶活性分别显著增加165.1%、359.6%和622.9%,平均增加382.5%。说明阿魏酸促进尖孢镰刀菌产生细胞壁水解酶,在200 mg/L浓度下化感促进效应均达到最强,且阿魏酸对细胞壁降解酶活性的促进效应表现为淀粉酶 > 蛋白酶 > 纤维素酶 > 果胶酶(图1)。
![]() 图 1 不同浓度阿魏酸处理尖孢镰刀菌分泌的细胞壁降解酶活性[注(Note):柱上或线上不同字母表示不同阿魏酸浓度处理间差异显著Different letters above the bars or line mean significant difference among treatments (P < 0.05).]Figure 1. Activities of cell wall degrading enzymes secreted by Fusarium oxysporum f. sp. fabae under differentferulic acid concentrations
图 1 不同浓度阿魏酸处理尖孢镰刀菌分泌的细胞壁降解酶活性[注(Note):柱上或线上不同字母表示不同阿魏酸浓度处理间差异显著Different letters above the bars or line mean significant difference among treatments (P < 0.05).]Figure 1. Activities of cell wall degrading enzymes secreted by Fusarium oxysporum f. sp. fabae under differentferulic acid concentrations2.3.2 阿魏酸对尖孢镰刀菌产毒的影响
阿魏酸处理显著增加尖孢镰刀菌分泌的枯萎酸含量 (P < 0.05)。与对照 (0 mg/L) 相比,50、100和200 mg/L阿魏酸处理显著增加枯萎酸含量107.6%、171.5%和236.2%,平均增加171.6% (图2)。表明阿魏酸对尖孢镰刀菌产毒具有促进作用,枯萎酸含量随阿魏酸处理浓度增加而提高。
2.4 阿魏酸对蚕豆根系组织结构的化感效应
2.4.1 阿魏酸处理对蚕豆根系皮层细胞的影响
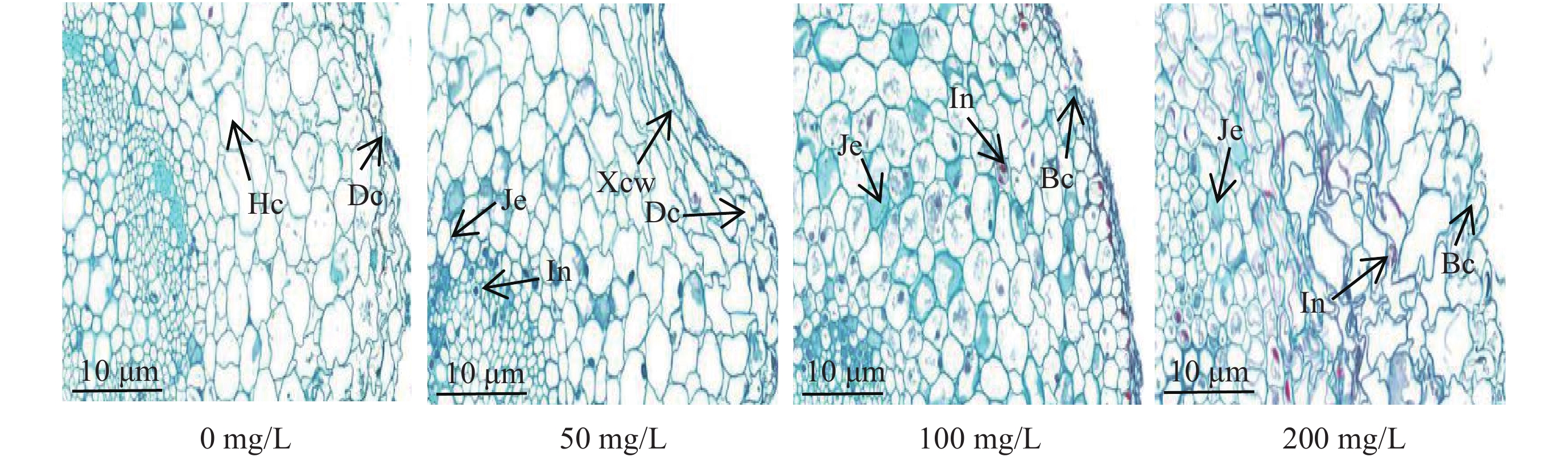
阿魏酸处理对蚕豆根系皮层细胞的影响如图3所示。0 mg/L浓度下,中皮层细胞轻微变形,排列有序,无增厚现象;50 mg/L浓度下,表皮细胞轻微变形,细胞壁出现明显增厚现象,细胞中出现少量的内含物和胶状物;100 mg/L浓度下,细胞壁破裂,细胞中的内含物和胶状物增多;200 mg/L浓度下,细胞变形严重,层次错乱不清,内含物和胶状物充满整个细胞,外层细胞壁破裂程度明显重于内层。表明阿魏酸胁迫加重蚕豆根系皮层细胞变形,且在200 mg/L浓度下效果最明显。
2.4.2 阿魏酸处理对蚕豆根系木质部导管的影响
如图4所示,蚕豆根系木质部导管横切面形状规则,呈圆形或椭圆形,且与中柱薄壁细胞紧密相连,无间隙。阿魏酸0 mg/L浓度处理,少量导管变细,并出现少量的胶状物;50 mg/L浓度处理,导管变细程度加重,内含物和胶状物明显增多;100 mg/L浓度处理,导管被内含物和胶状物堵塞严重,出现导管壁增厚现象;200 mg/L浓度处理,所有导管均已破裂,层次模糊,内含物和胶状物充满整个细胞。
3. 讨论
3.1 阿魏酸对蚕豆幼苗生长和枯萎病发生的影响
作物专一化和规模化的种植,导致农田土壤连作障碍问题日趋严重,成为制约现代农业可持续发展的主要障碍之一[6]。连作障碍是作物与土壤综合作用的结果,其中植物自毒作用被认为是导致连作障碍的重要诱因之一[6]。研究者已经从多种作物中分离到多种酚酸类自毒物质,主要包括对羟基苯甲酸、肉桂酸、苯甲酸、阿魏酸、水杨酸、香草酸等[8, 12, 19-20]。在连作蚕豆根际土壤和根系分泌物中也检测到多种酚酸类物质存在[12, 21]。研究表明,酚酸类物质积累到一定浓度会对蚕豆生长造成严重的危害[21]。生物量是表征植物生长状况的一项基本参数,生物量的大小对植物生长发育的影响至关重要[22]。黄玉茜等[23]的研究发现,花生连作化感自毒物质香草酸对幼苗生长存在一定的抑制作用,且该抑制作用具有一定的浓度效应,其中幼苗主根长和单株干重均随香草酸浓度增加而降低,即其具有显著的自毒效应。本研究中,阿魏酸处理显著降低蚕豆幼苗的最大叶长、最大叶宽、单株叶片数和株高,说明阿魏酸胁迫可显著抑制蚕豆幼苗地上部的生长 (表1)。焦晓林等[24]的研究也发现,添加p-香豆酸后西洋参植株展叶推迟,添加浓度高时约85%叶片不能完全展开,叶片生长受到严重抑制。
在作物生长期间,化感物质要发挥作用首先要被作物吸收,根系是最先被影响到的器官,其受到的影响也会较其他部分更加显著[13]。土壤中积累的酚酸类物质首先对作物地下部的生长发育产生抑制作用,如苹果连作自毒物质根皮苷对平邑甜茶幼苗伤害最大,根鲜重仅为对照的42.3%[25]。本研究中,阿魏酸不同浓度处理显著降低蚕豆幼苗主根长11.3%~21.6%和根干重9.8%~41.4%(表1),根系指标的下降将导致根系对养分吸收能力的降低,最终使地下部干物质积累量减少,进而加剧连作障碍发生 。
大量研究表明,自毒物质不仅抑制作物生长,而且会加剧病害的发生,尤其是土传病害的暴发流行。水杨酸、没食子酸、苯甲酸、3-苯基丙酸和肉桂酸是人参根系分泌的主要化感自毒物质,这5种酚酸类物质的存在会增加人参锈腐病的发病率,加重人参连作障碍[19]。田给林[26]的研究表明,草莓苗期高浓度的阿魏酸胁迫能增加草莓被尖孢镰刀菌侵染的风险。丁香酸、阿魏酸、肉桂酸、苯甲酸与尖孢镰刀菌协同作用比较明显,供试酸浓度越高,甜瓜枯萎病发生越严重[27]。枯萎病是蚕豆连作障碍中最重要的土传病害之一,其发生和传播受到土壤中积累的酚酸类自毒物质的影响[13]。本研究中,接种尖孢镰刀菌 (FOF) 条件下,蚕豆枯萎病的发病率和病情指数均随阿魏酸处理浓度增加而显著增加,表明蚕豆连作障碍的发生及加重是化感自毒物质和土传病害共同作用的结果。
3.2 阿魏酸对尖孢镰刀菌的化感效应
植物通过地上部淋溶、根系分泌和残茬腐解等途径释放化感物质进入土壤,而酚酸类物质是研究最为广泛的一类自毒物质[26]。酚酸类自毒物质对土传病害发生的助长效应,直接表现为对病原菌的刺激作用。酚酸类物质对人参锈腐病发生严重度的大小取决于酚酸在土壤中的浓度大小,在适宜浓度下对人参锈腐病菌的刺激作用会增加人参的患病几率[14]。本研究结果表明,阿魏酸50 mg/L处理显著抑制尖孢镰刀菌菌丝生长,其浓度越高抑制效果越明显。在黄瓜枯萎病研究中也发现了相似的结果,即低于50 mg/L的酚酸类物质 (香草酸、对羟基苯甲酸和阿魏酸) 外源处理42 h后,对黄瓜枯萎病菌菌丝生长有轻微的刺激作用,但无显著影响;供试酸浓度高于50 mg/L时出现抑制菌丝生长的现象[28]。Tian等[29]对草莓炭疽病、冠腐病的研究发现,不同浓度阿魏酸 (0、50、100、200、400、800 mg/L) 处理条件下,100 mg/L浓度处理时炭疽病、冠腐病菌菌丝生长被显著抑制,随阿魏酸处理浓度增加,抑制作用增强。本研究中尽管阿魏酸处理显著抑制尖孢镰刀菌菌丝生长 (表3),但水培试验结果发现阿魏酸胁迫促进枯萎病发生 (表2),表明阿魏酸可能通过增加枯萎病菌的致病力 (产酶和产毒) 而促进枯萎病发生。
表 2 不同浓度阿魏酸处理对蚕豆枯萎病发病率和病情指数的影响Table 2. Fusarium wilt incidence and index of faba bean affected by ferulic acid concentrations阿魏酸浓度 (mg/L)
Ferulic acid concentration发病率 (%)
Incidence病情指数
Disease index0 16.7 ± 0.0 c 3.3 ± 0.0 c 50 27.8 ± 9.6 c 7.1 ± 2.7 b 100 66.7 ± 16.7 b 22.2 ± 8.4 b 200 100.0 ± 0.0 a 58.9 ± 10.7 a 注(Note):数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). 在寄主植物与病原微生物互作中,病原菌入侵过程产生的细胞壁降解酶和毒素等物质能够促进病原菌快速入侵寄主且在寄主中生存和繁殖[30]。细胞壁是病原菌入侵寄主植物的第一道防线,病原菌入侵寄主植物时,通常会分泌出一系列细胞壁水解酶 (纤维素酶、果胶酶、蛋白酶和淀粉酶等) 对寄主细胞壁进行降解[31]。细胞壁的降解不仅为病原菌侵入提供有利的条件,还可以从细胞内释放出多糖等营养物质供病原菌生长[31]。陈晓林等[32]研究发现,苹果树腐烂病菌在活体外和寄主体内均能分泌一系列的细胞壁降解酶 (木聚糖酶、纤维素酶、多聚半乳糖醛酸酶等),且细胞壁降解酶活性与其致病力呈正相关关系。Wu等[33]对百合枯萎病的研究发现,在尖孢镰刀菌培养基中加入邻苯二甲酸后显著增加了果胶酶和纤维素酶活性。
本研究中,阿魏酸处理显著增加尖孢镰刀菌产生的果胶酶、纤维素酶、淀粉酶和蛋白酶活性,且阿魏酸胁迫下尖孢镰刀菌分泌的细胞壁降解酶以淀粉酶活性最强,说明淀粉酶是尖孢镰刀菌分泌的主要细胞壁降解酶,作用于细胞内分解胞内的淀粉;尖孢镰刀菌分泌的蛋白酶、纤维素酶和果胶酶活性次之,能够降解细胞壁中的纤维素、果胶和蛋白质,有利于病原菌的进一步入侵。本研究结果暗示了阿魏酸胁迫下蚕豆根系细胞壁的降解是由多种酶共同决定的,不同酶作用部位不同,最终多种酶协同作用,使尖孢镰刀菌更加快速的侵入蚕豆根系。苹果树腐烂病菌在活体外和寄主体内分泌的细胞壁降解酶均以木聚糖酶活性最高,纤维素酶活性最低[32],与本研究结果不同,原因可能是不同的病原菌作用于不同的寄主植物导致分泌的细胞壁降解酶不同。
在成功侵入寄主体内之后,病原菌下一步的致病策略通常是分泌毒素来调控植物的生理生化过程,使其向有利于病原菌生长繁殖的方向改变[30]。枯萎酸的产量与尖孢镰刀菌毒性呈显著正相关关系,且在发病植株中枯萎酸含量与植株的发病程度也呈正相关[34]。枯萎酸的致萎作用是因为细胞膜系统是其主要作用位点之一,植物根系细胞膜被枯萎酸破坏,使植物体内的代谢功能紊乱,防卫机能丧失,根系活力下降,造成植株地上部缺水萎焉[35]。本研究中,阿魏酸处理显著增加枯萎酸含量107.6%~236.2% (图2),从而提高尖孢镰刀菌的致病力。表明细胞壁降解酶和枯萎酸协同作用,促进尖孢镰刀菌进入寄主体内并产生更多的毒素和细胞壁降解酶,进而加速蚕豆枯萎死亡进程。
植物通过改变细胞结构和细胞器功能来应对外界环境的压力,研究逆境胁迫下植物细胞结构的变化,可以为植物损伤和抗逆机制研究提供细胞学依据。植物细胞组织结构分析结果是研究植物化感作用最直接的实验证据之一[36]。大量研究表明,在病原物或病原菌入侵后,植物为了阻止病原菌的进一步扩展,在细胞或组织结构上发生一系列变化来抵御外界的不良胁迫,例如在维管束中产生胼胝质、侵填体、胶质等物质,从而堵塞部分导管,达到阻止病原菌向上运输的作用[37-38]。齐永志等[39]研究发现,连作自毒物质对羟基苯甲酸胁迫下,草莓根系表皮细胞、皮层细胞、中柱鞘细胞、薄壁细胞和导管中的尖孢镰刀菌感染率均显著提高,且各层细胞结构完整性、排列紧密度和细胞间轮廓清晰度也均明显降低,草莓根系组织结构受损严重,枯萎病发生明显加重。
本研究结果显示,阿魏酸胁迫下,蚕豆根系皮层细胞和导管细胞均出现不同程度损伤,且随阿魏酸浓度增加,皮层细胞由最初的排列整齐有序到细胞变形扭曲,错乱不清;导管细胞逐渐变小,导管壁增厚,内含物和胶状物充满整个细胞堵塞导管 (图3、图4)。原因可能是阿魏酸胁迫促进尖孢镰刀菌产生高活性的细胞壁降解酶,使蚕豆根系细胞壁降解,细胞结构变形扭曲、破裂,加速尖孢镰刀菌进入根系并继续分泌细胞壁降解酶和枯萎酸,蚕豆为了阻止镰刀菌进一步侵入,在根系形成大量的木质素和胼胝质沉积,使木质部导管壁增厚,内含物和胶状物堵塞导管,形成一个临时的应激防御系统[37]。夏启中等[38]研究发现,胼胝质是一类多糖聚合物,在病原菌侵入寄主植物后,通常形成胼胝质沉积,使细胞壁加厚或形成乳突以阻碍病原菌的进一步侵染。但随阿魏酸胁迫浓度增加,细胞防御系统崩溃,大量的胶状物和内含物充满整个细胞,造成木质部导管的严重堵塞,进而阻止营养物质和水分的运输[40],加速蚕豆枯萎死亡进程。在花生根系分泌物中也发现低浓度的苯乙酮对花生青枯病菌生长有促进作用,青枯病菌入侵花生后在导管中产生大量胞外多糖等胶状物质,造成导管堵塞,阻碍水分和养分的运输,从而导致花生植株凋萎,逐渐死亡[41]。
4. 结论
自毒物质阿魏酸处理显著抑制蚕豆幼苗生长,同时显著促进尖孢镰刀菌分泌细胞壁降解酶和枯萎酸,加剧对蚕豆根系皮层细胞的损伤和导管堵塞,降低蚕豆的组织结构抗性,为尖孢镰刀菌侵染创造有利条件,最终促进蚕豆枯萎病的发生和危害。这表明自毒物质和土传病菌双重胁迫是加重蚕豆连作障碍的重要原因。
-
图 2 不同浓度阿魏酸处理尖孢镰刀菌分泌的枯萎酸含量
[注(Note):柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars mean significant difference among treatments (P < 0.05).]
Figure 2. The contents of fusaric acid secreted by Fusarium oxysporum f. sp. fabae affected by different ferulic acid concentrations in liquid culture
图 1 不同浓度阿魏酸处理尖孢镰刀菌分泌的细胞壁降解酶活性
[注(Note):柱上或线上不同字母表示不同阿魏酸浓度处理间差异显著Different letters above the bars or line mean significant difference among treatments (P < 0.05).]
Figure 1. Activities of cell wall degrading enzymes secreted by Fusarium oxysporum f. sp. fabae under differentferulic acid concentrations
表 1 不同浓度阿魏酸处理对蚕豆幼苗生长的影响
Table 1 Effects of different ferulic acid concentrations on the growth of faba bean seeding
阿魏酸浓度
Ferulic acid concentration
(mg/L)单株叶片数
Leaf number
per plant最大叶长
Max. leaf
length
(cm)最大叶宽
Max. leaf
width
(cm)株高
Height
(cm)主根长
Main root length
(cm)地上部干重Shoot dry weight (g) 根干重
Root dry weight
(g)根冠比Root/shoot ratio 0 18.4 ± 0.2 a 6.1 ± 0.1 a 3.9 ± 0.1 a 37.9 ± 0.9 a 14.0 ± 0.9 a 1.0 ± 0.1 a 0.4 ± 0.0 a 0.4 ± 0.0 a 50 17.5 ± 1.4 a 4.8 ± 0.1 b 3.1 ± 0.2 b 37.3 ± 1.2 a 12.4 ± 0.5 b 1.0 ± 0.1 a 0.4 ± 0.0 b 0.4 ± 0.0 a 100 17.3 ± 0.6 ab 4.6 ± 0.1 bc 2.8 ± 0.1 c 33.4 ± 1.6 b 11.6 ± 1.1 b 1.0 ± 0.1 a 0.4 ± 0.0 c 0.3 ± 0.0 b 200 15.7 ± 0.6 b 4.3 ± 0.3 c 2.4 ± 0.0 d 28.8 ± 1.4 c 10.9 ± 0.5 b 1.0 ± 0.0 a 0.3 ± 0.0 d 0.3 ± 0.0 c 注(Note):数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). 表 3 不同阿魏酸处理浓度下不同培养天数尖孢镰刀菌落直径和化感指数
Table 3 Colony diameter and response index of Fusarium oxysporum f. sp. fabae affected by different ferulic acidconcentrations in different incubation days
阿魏酸浓度
Ferulic acid concentration
(mg/L)2 d 3 d 4 d 5 d 6 d CD (mm) RI CD (mm) RI CD (mm) RI CD (mm) RI CD (mm) RI 0 4.9 ± 0.4 a 6.4 ± 0.3 a 6.3 ± 0.2 a 6.8 ± 0.3 a 7.6 ± 0.3 a 50 4.0 ± 0.1 b –0.2 ± 0.1 a 4.9 ± 0.1 b –0.2 ± 0.1 a 5.8 ± 0.1 b –0.1 ± 0.0 a 6.1 ± 0.1 b –0.1 ± 0.0 a 6.4 ± 0.1 b –0.2 ± 0.0 a 100 3.9 ± 0.2 b –0.2 ± 0.1 a 4.8 ± 0.1 b –0.2 ± 0.0 a 5.5 ± 0.1 c –0.1 ± 0.0 a 5.9 ± 0.1 b –0.1 ± 0.0 a 6.2 ± 0.1 bc –0.2 ± 0.0 a 200 3.8 ± 0.1 b –0.2 ± 0.1 a 4.7 ± 0.1 b –0.3 ± 0.0 a 5.5 ± 0.1 c –0.1 ± 0.0 a 5.9 ± 0.1 b –0.1 ± 0.0 a 6.1 ± 0.1 c –0.2 ± 0.0 a 注(Note):CD—菌落直径 Colony diameter; RI—化感指数 Response index. 数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). 表 2 不同浓度阿魏酸处理对蚕豆枯萎病发病率和病情指数的影响
Table 2 Fusarium wilt incidence and index of faba bean affected by ferulic acid concentrations
阿魏酸浓度 (mg/L)
Ferulic acid concentration发病率 (%)
Incidence病情指数
Disease index0 16.7 ± 0.0 c 3.3 ± 0.0 c 50 27.8 ± 9.6 c 7.1 ± 2.7 b 100 66.7 ± 16.7 b 22.2 ± 8.4 b 200 100.0 ± 0.0 a 58.9 ± 10.7 a 注(Note):数据为平均值 ± 标准差 Data in the table are means ± SD; 同列数据后不同字母表示处理间差异显著 (P < 0.05) Values followed by different letters in a column mean significant difference among treatments (P < 0.05). -
[1] 全紫曼, 陈远学, 刘明, 等. 成都平原蚕豆高效根瘤菌的筛选及其促生功能初步评价[J]. 植物营养与肥料学报, 2019, 25(6): 943-952. DOI: 10.11674/zwyf.18207 Quan Z M, Chen Y X, Liu M, et al. Screening of high efficiency symbiotic rhizobia to faba bean and a preliminary investigation on their promotion ability in Chengdu Plain [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(6): 943-952. DOI: 10.11674/zwyf.18207
[2] 董艳, 董坤, 杨智仙, 等. 肉桂酸对蚕豆枯萎病发生的影响及间作缓解机制[J]. 土壤学报, 2017, 54(2): 503-515. Dong Y, Dong K, Yang Z X, et al. Effect of cinnamic acid on incidence of faba bean fusarium wilt and incidence-mitigating mechanisms of wheat and faba bean intercropping [J]. Acta Pedologica Sinica, 2017, 54(2): 503-515.
[3] Stoddard F L, Nicholas A H, Rubiales D, et al. Integrated pest management in faba bean [J]. Field Crops Research, 2010, 115(3): 308-318. DOI: 10.1016/j.fcr.2009.07.002
[4] 杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22. Yang Z, Dai C C, Wang X X, et al. Advance in research on rhizosphere microbial mechanisms of crop soil-borne fungal diseases [J]. Acta Pedologica Sinica, 2019, 56(1): 12-22.
[5] 李敏慧, 苑曼琳, 姜子德, 等. 香蕉枯萎病菌致病机理研究进展[J]. 果树学报, 2019, 36(6): 803-811. Li M H, Yuan M L, Jiang Z D, et al. Research progress in pathogenic mechanism of Fusarium oxysporum f. sp. Cubense [J]. Journal of Fruit Science, 2019, 36(6): 803-811.
[6] 李敏, 张丽叶, 张艳江, 等. 酚酸类自毒物质微生物降解转化研究进展[J]. 生态毒理学报, 2019, 14(3): 72-78. Li M, Zhang L Y, Zhang Y J, et al. Review on the biodegradation and metabolism of autotoxic phenolic acids [J]. Asian Journal of Ecotoxicology, 2019, 14(3): 72-78.
[7] 姜伟涛, 尹承苗, 段亚楠, 等. 根皮苷和串珠镰孢菌加重苹果连作土壤环境及其对平邑甜茶生长的抑制[J]. 园艺学报, 2018, 45(1): 21-29. Jiang W T, Yin C M, Duan Y N, et al. Phloridzin and fusarium moniliforme aggravated the replanted soil environment and inhibited the growth of malus hupehensis seedlings [J]. Acta Horticulturae Sinica, 2018, 45(1): 21-29.
[8] 李云龙, 王宝英, 常亚锋, 等. 土壤强还原处理对三七连作障碍因子及再植三七生长的影响[J]. 土壤学报, 2019, 56(3): 703-715. DOI: 10.11766/trxb201806110164 Li Y L, Wang B Y, Chang Y F, et al. Effects of reductive soil disinfestations on obstacles and growth of replant seedlings in Sanqi Ginseng monocropped soils [J]. Acta Pedologica Sinica, 2019, 56(3): 703-715. DOI: 10.11766/trxb201806110164
[9] Wu H S, Yin X M, Liu D Y, et al. Effect of fungal fusaric acid on the root and leaf physiology of watermelon (Citrullus lanatus) seedlings [J]. Plant and Soil, 2008, 308(1-2): 255-266. DOI: 10.1007/s11104-008-9627-z
[10] Wu H S, Wang Y, Zhang C Y, et al. Physiological and biochemical responses of in vitro Fusarium oxysporum f. sp. niveum to benzoic acid [J]. Folia Microbiologica, 2009, 54(2): 115-122. DOI: 10.1007/s12223-009-0017-6
[11] 杨敏. 三七根系皂苷的自毒作用机制研究[D]. 昆明: 云南农业大学博士学位论文, 2015. Yang M. Investigation on autotoxic mechanism of ginsenosides from Panax notoginseng roots strains[D]. Kunming: PhD Dissertation of Yunnan Agricultural University, 2015.
[12] 董艳, 董坤, 杨智仙, 等. 间作减轻蚕豆枯萎病的微生物和生理机制[J]. 应用生态学报, 2016, 27(6): 1984-1992. Dong Y, Dong K, Yang Z X, et al. Microbial and physiological mechanisms for alleviating fusarium wilt of faba bean in intercropping system[J]. Chinese Journal of Applied Ecology, 2016, 27(6): 1984-1992.
[13] 陈玲, 赵骞, 董坤, 等. 苯甲酸和肉桂酸促进蚕豆枯萎病发生的生理生化机制[J]. 植物保护学报, 2019, 46(02): 298-304. Chen L, Zhao Q, Dong K, et al. Physiological mechanism of faba bean fusarium wilt promoted by benzoic acid and cinnamic acid [J]. Acta Phytophylacica Sinica, 2019, 46(02): 298-304.
[14] 李自博, 周如军, 解宇娇, 等. 人参连作根际土壤中酚酸物质对人参锈腐病菌的化感效应[J]. 应用生态学报, 2016, 27(11): 3616-3622. Li Z B, Zhou R J, Xie Y J, et al. Allelopathic effects of phenolic compounds of ginseng root rhizosphere on Cylindrocarpon destructans [J]. Chinese Journal of Applied Ecology, 2016, 27(11): 3616-3622.
[15] 曹春蕾, 崔宝凯, 秦问敏. 桑木层孔菌液体培养过程中几种胞外酶活性的变化[J]. 菌物学报, 2011, 3(2): 275-280. Cao C L, Cui B K, Qin W M. Activity changes of several extracellular enzymes in liquid culture of Phellinus mori [J]. Mycosystema, 2011, 3(2): 275-280.
[16] 陈钰泉, 刘玉婷, 仇敏, 等. 植物皂素提取液对枯草芽孢杆菌发酵表达蛋白酶与果胶酶的影响[J]. 江苏农业科学, 2019, 47(11): 322-326. Chen Y Q, Liu Y T, Chou M, et al. Effects of plant saponin extracts on fermentation expression of protease and pectinase in bacillus subtilis [J]. Jiangsu Agricultural Sciences, 2019, 47(11): 322-326.
[17] 陈捷. 现代植物病理学研究方法[M]. 北京: 中国农业出版社, 2007. Chen J. Research methods of modern plant pathology[M]. Beijing: China Agriculture Press, 2007.
[18] 王宁, 齐永志, 时荣荣, 等. 草莓根系的石蜡切片制作及侧根发育过程的观察[J]. 河北农业大学学报, 2013, 36(3): 34-38. Wang N, Qi Y Z, Shi R R, et al. Manufacture of paraffin section on strawberry root and observation on the development of lateral root [J]. Journal of Hebei Agricultural University, 2013, 36 (3): 34-38.
[19] 李自博. 人参根系自毒物质在连作障碍中的化感作用及其缓解途径研究[D]. 沈阳: 沈阳农业大学博士学位论文, 2018. Li Z B. Allelopahy of autotoxic compounds and mitigation method for ginseng continuous cropping obstacle[D]. Shenyang: PhD Dissertation of Shenyang Agricultural University, 2018.
[20] 齐永志, 苏媛, 王宁, 等. 对羟基苯甲酸胁迫下尖孢镰刀菌侵染草莓根系的组织结构观察[J]. 园艺学报, 2015, 42(10): 1909-1918. Qi Y Z, Su Y, Wang N, et al. Observation on histological structure of strawberry roots after inoculating Fusarium oxysporum f. sp. fragariae under 4-hydroxybenzoic acid stress [J]. Acta Horticulturae Sinica, 2015, 42(10): 1909-1918.
[21] Asaduzzaman M, Asao T. Autotoxicity in beans and their allelochemicals [J]. Scientia Horticulturae, 2012, 134: 26-31. DOI: 10.1016/j.scienta.2011.11.035
[22] 潘凤兵, 王海燕, 王晓芳, 等. 蚓粪减轻苹果砧木平邑甜茶幼苗连作障碍的土壤生物学机制[J]. 植物营养与肥料学报, 2019, 25(6): 925-932. DOI: 10.11674/zwyf.18244 Pan F B, Wang H Y, Wang X F, et al. Biological mechanism of vermicompost reducing the replant disease of Malus hupehensis Rehd. Seedlings [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(6): 925-932. DOI: 10.11674/zwyf.18244
[23] 黄玉茜, 杨劲峰, 梁春浩, 等. 香草酸对花生种子萌发、幼苗生长及根际微生物区系的影响[J]. 中国农业科学, 2018, 51(9): 1735-1745. DOI: 10.3864/j.issn.0578-1752.2018.09.011 Huang Y Q, Yang J F, Liang C H, et al. Effects of vanillic acid on seed germination, seedling growth and rhizosphere microflora of peanut [J]. Scientia Agricultura Sinica, 2018, 51(9): 1735-1745. DOI: 10.3864/j.issn.0578-1752.2018.09.011
[24] 焦晓林, 毕晓宝, 高微微. p-香豆酸对西洋参的化感作用及生理机制[J]. 生态学报, 2015, 35 (9): 3006-3013. Jiao X L, Bi X B, Gao W W. Allelopathic effect of p-coumaric acid on American ginseng and its physiological mechanism [J]. Acta Ecologica Sinica, 2015, 35(9): 3006-3013.
[25] 尹承苗, 胡艳丽, 王功帅, 等. 苹果连作土壤中主要酚酸类物质对平邑甜茶幼苗根系的影响[J]. 中国农业科学, 2016, 49(5): 961-969. DOI: 10.3864/j.issn.0578-1752.2016.05.016 Yin C M, Hu Y L, Wang G S, et al. Effect of main phenolic acids of the apple replanted soil on the roots of malus hupehensis rehd. seedlings [J]. Scientia Agricultura Sinica, 2016, 49(5): 961-969. DOI: 10.3864/j.issn.0578-1752.2016.05.016
[26] 田给林. 连作草莓土壤酚酸类物质的化感作用及其生物调控研究[D]. 北京: 中国农业大学博士学位论文, 2015. Tian G L. Allelopathic effect and biological regulation of phenolic acids in the continuous cropping strawberry soil[D]. Beijing: PhD Dissertation of China Agricultural University, 2015.
[27] 杨瑞秀, 高增贵, 姚远, 等. 甜瓜根系分泌物中酚酸物质对尖孢镰孢菌的化感效应[J]. 应用生态学报, 2014, 25(8): 2355-2360. Yang R X, Gao Z G, Yao Y, et al. Allelopathic effects of phenolic compounds of melon root exudates on Fusarium oxysporum f. sp. Melonis [J]. Chinese Journal of Applied Ecology, 2014, 25(8): 2355-2360.
[28] 胡元森, 吴坤, 李翠香, 等. 酚酸物质对黄瓜幼苗及枯萎病菌菌丝生长的影响[J]. 生态学杂志, 2007, 26(11): 1738-1742. Hu Y S, Wu K, Li C X, et al. Effects of phenolic compounds on the growth of Cucumis sativus seedlings and Fusarium oxysporumhypha [J]. Chinese Journal of Ecology, 2007, 26(11): 1738-1742.
[29] Tian G L, Bi Y M, Sun Z J, et al. Phenolic acids in the plow layer soil of strawberry fields and their effects on the occurrence of strawberry anthracnose [J]. European Journal of Plant Pathology, 2015, 143(3): 581-594. DOI: 10.1007/s10658-015-0711-y
[30] 董鲜. 土传香蕉枯萎病发生的生理机制及营养防控效果研究[D]. 江苏: 南京农业大学博士学位论文, 2014. Dong X. Study on physiological mechanisms of soil-borne banana fusarium wilt occurrence and nutrients control effect of wilt disease [D]. Jiangsu: PhD Dissertation of Nanjing Agricultural University, 2014.
[31] 杨志敏, 毕阳, 李永才, 等. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J]. 中国农业科学, 2012, 45(1): 127-134. DOI: 10.3864/j.issn.0578-1752.2012.01.015 Yang Z M, Bi Y, Li Y C, et al. Changes of cell wall degrading enzymes in tuber tissue slices infected by fusarium sulphureum[J]. Scientia Agricultura Sinica, 2012, 45(1): 127-134. DOI: 10.3864/j.issn.0578-1752.2012.01.015
[32] 陈晓林, 牛程旺, 李保华, 等. 苹果树腐烂病菌产生细胞壁降解酶的种类及其活性分析[J]. 华北农学报, 2012, 27(2): 207-212. DOI: 10.3969/j.issn.1000-7091.2012.02.039 Chen X L, Niu C W, Li B H, et al. The kinds and activities of cell wall-degrading enzymes produced by valsa ceratosperma [J]. Acta Agriculturae Boreali-Sinica, 2012, 27(2): 207-212. DOI: 10.3969/j.issn.1000-7091.2012.02.039
[33] Wu K, Yuan S F, Xun G H, et al. Root exudates from two tobacco cultivars affect colonization of ralstonia solanacearum and the disease index [J]. European Journal of Plant Pathology, 2015, 141(4): 667-677. DOI: 10.1007/s10658-014-0569-4
[34] 周金燕. 不同氮素营养对黄瓜枯萎病发生的影响机制研究[D]. 江苏: 南京农业大学博士学位论文, 2016. Zhou J Y. Studies on mechanisms of different nitrogen nutrition on effecting cucumber fusarium wilt occurrence[D]. Jiangsu: PhD Dissertation of Nanjing Agricultural University, 2016.
[35] 马国斌, 林德佩, 王叶筠, 等. 西瓜枯萎病菌镰刀菌酸对西瓜苗作用机制的初步探讨[J]. 植物病理学报, 2000, (4): 373-374. DOI: 10.3321/j.issn:0412-0914.2000.04.018 Ma G B, Lin D P, Wang Y J, et al. Studies on the wilting mechanism of fusaric acids of Fusarium oxysporum on watermelon [J]. Acta Phytopathologica Sinica, 2000, (4): 373-374. DOI: 10.3321/j.issn:0412-0914.2000.04.018
[36] Zeng R S, Luo S M, Yue H S, et al. Physiological and bio-chemical mechanism of allelopathy of secalonic acid F on higher plants[J]. Agronomy Journal, 2001, 93(1): 72-79. DOI: 10.2134/agronj2001.93172x
[37] Moustafa B, Alejandro P D L, Diego R, et al. Physical and chemical barriers in root tissues contribute to quantitative resistance to Fusarium oxysporum f. sp. pisi in Pea [J]. Frontiers in plant science, 2018, 9: 199-214. DOI: 10.3389/fpls.2018.00199
[38] 夏启中, 张明菊. 植物抗病的物质代谢基础[J]. 黄冈职业技术学院学报, 2004, 6(3): 38-4. DOI: 10.3969/j.issn.1672-1047.2014.03.11 Xia Q Z, Zhang M J. Metabolic basis of plant-disease resistance [J]. Journal of Huanggang Polytechnic, 2014, 6(3): 38-41. DOI: 10.3969/j.issn.1672-1047.2014.03.11
[39] 齐永志, 苏媛, 王宁, 等. 对羟基苯甲酸胁迫下尖孢镰刀菌侵染草莓根系的组织结构观察[J]. 园艺学报, 2015, 42(10): 1909-1918. Qi Y Z, Su Y, Wang N, et al. Observation on histological structure of strawberry roots after inoculating Fusarium oxysporum f. sp. fragariae under 4-hydroxybenzoic acid stress [J]. Acta Horticulturae Sinica, 2015, 42(10): 1909-1918.
[40] 郭晋云, 胡晓峰, 李勇, 等. 黄瓜枯萎病对黄瓜光合和水分生理特性的影响[J]. 南京农业大学学报, 2011, 34(1): 79-83. Guo J Y, Hu X F, Li Y, et al. Effect of Fusarium oxysporum f. sp. cucumerinum on photosynthesis and water physiological characteristics in cucumber [J]. Journal of Nanjing Agricultural University, 2011, 34(1): 79-83.
[41] 滕应, 任文杰, 李振高, 等. 花生连作障碍发生机理研究进展[J]. 土壤, 2015, 47(2): 259-265. Teng Y, Ren W J, Li Z G, et al. Advance in mechanism of peanut continuous cropping obstacle [J]. Soils, 2015, 47(2): 259-265.
-
期刊类型引用(8)
1. 刘可意,王晓香,张立业,邱佳奇,李寒,郭素萍,刘洋,张雪梅. 红树莓根系水提物对间作物种子萌发及生长的化感效应. 分子植物育种. 2025(06): 1961-1967 .  百度学术
百度学术
2. 杜丹,杨艳,杨雪萍,孙大生,原向阳,宋喜娥,杨雪芳. 连作谷子根腐病病原鉴定及其致病性分析. 植物病理学报. 2024(04): 871-876 .  百度学术
百度学术
3. 赵静,万琼莲,焦蓉,王占娣,王连春. 三七种植土壤中对羟基苯甲酸对尖孢镰刀菌的化感作用. 西南农业学报. 2023(01): 112-117 .  百度学术
百度学术
4. 周远锋,冯瑞,汤利. 根系分泌物介导的间作防控土传病害作用机制研究进展. 云南农业大学学报(自然科学). 2023(02): 353-360 .  百度学术
百度学术
5. 陈雅恬,蔡雪梅,朱开宪,邓静,乔明锋,苗保河. 开花蚕豆烹饪工艺优化及品质分析. 食品工业科技. 2023(11): 219-229 .  百度学术
百度学术
6. 宫树森,杨霏,王青芬,杨自云,吴田. 4CL基因在海巴戟叶片莨菪亭累积过程中的功能研究. 热带作物学报. 2022(10): 1989-1997 .  百度学术
百度学术
7. 涂玉婷,黄继川,彭智平,吴雪娜,廖伟杰. 生物炭对酚酸胁迫下番茄生长和土壤微生态的影响. 广东农业科学. 2021(01): 94-103 .  百度学术
百度学术
8. 潘凤兵,姜伟涛,陈冉,徐明娜,陈学森,沈向,尹承苗,毛志泉. 蚯蚓磨浆发酵产物减轻苹果连作障碍的机制. 植物营养与肥料学报. 2021(03): 429-439 .  本站查看
本站查看
其他类型引用(6)



 下载:
下载: