Bibliometric analysis of research hotspots and trends of biological nitrogen fixation at home and abroad from 1990 to 2023
-
摘要:
为系统了解国内外生物固氮的研究现状,本研究基于在Web of Science (WOS)核心合集数据库及中国知网(CNKI) 检索的1990—2023年有关生物固氮研究的文献,利用Citespace、VOSviewer、HistCite等文献计量工具,对发文数量、主要国家(地区)与机构、主要发文期刊和研究学者、重要文献、研究热点以及研究变化趋势等进行了计量分析。结果表明,1)近24年来,生物固氮研究领域发文量呈逐年增多趋势,2010年后中国发文占比显著增多,并成为WOS数据库中生物固氮领域发文量排名第2的国家,且与美国、巴西、德国等发文量较多的国家之间联系密切。植物科学、微生物学是英文发文量较多的学科,生物学、作物学是中文发文量较多的学科,都与农业科学紧密相关。生物固氮相关研究的中英文论文主要发文期刊是《生物技术通报》、《Plant and Soil》、《Soil Biology & Biochemistry》。Hungria M、Urquiaga S、Boddey R M和李友国是该领域发文较多的研究学者。2)生物固氮关键词聚类网络主要可分为生物固氮相关微生物及其定殖,生物固氮对农业生产的影响,生物固氮分子机理,以及生物固氮影响因素等4类,如何提升生物固氮效率并扩大其应用范围成为研究者关注的焦点。3)生物固氮研究近些年的主要挑战包括:扩大根瘤菌宿主范围,提高根际联合固氮效率;将生物固氮引入禾谷类作物中,开发“氮肥自供型”作物;挖掘高效固氮微生物资源,优化菌肥应用技术等。4) 随着遗传工程、合成生物学、宏基因组学、转录组学等技术方法的应用以及多学科的交叉研究,更深入探究生物固氮的机理并将其应用到农业生产中,对于减轻农业生产对工业氮肥的依赖,实现绿色低碳农业生产具有重要意义。
Abstract:In order to comprehensively summarize the current research status of biological nitrogen fixation (BNF) globally and domestically. The relevant literatures on BNF were retrieved from the Web of Science (WOS) and the China National Knowledge Network (CNKI) databases from 1990 to 2023. By using Citespace, VOSviewer, HistCite, and other bibliometric tools, we analyzed the number of publications, leading countries/regions and institutions, significant journals and researchers, highly cited papers, emerging research hotpots and the challenges faced in the field. The results showed as follows: 1) Over the past 24 years, the number of BNF-related publications has increased annually. Since 2010, Chinese authors have significantly contributed to this field, ranking second in the WOS database. Notably, China has shown strong collaboration with countries like the United States, Brazil, and Germany. Most English-language BNF literature falls within plant science and microbiology, whereas Chinese-language literature is primarily categorized under biology and crop science. The significant journals publishing BNF research include Biotechnology Bulletin (Chinese), Plant and Soil, Soil Biology & Biochemistry. Prominent researchers in this field include Hungria M, Urquiaga S, Boddey R M, and Li Youguo. 2) The keyword clustering network divides BNF research into four key areas, microorganisms and their colonization, the impact of BNF on agricultural production, the molecular mechanism of BNF, and factors influencing BNF. All these research areas focus on enhancing BNF efficiency and broadening its application scope. 3) Future research on BNF faces several challenges, including expanding the host range of rhizobia, improving rhizosphere-associated nitrogen fixation efficiency, introducing BNF into cereal crops to develop “N-self-fertilizing” varieties, exploring efficient nitrogen-fixing microbial resources, and optimizing microbial fertilizer application technology. 4) Technological advancements such as genetic engineering, synthetic biology, metagenomics, and transcriptomics have sparked interdisciplinary research, providing tools for deeper exploration of BNF mechanisms and efficient application for green and low-carbon agricultural production.
-
Keywords:
- biological nitrogen fixation /
- bibliometric analysis /
- colonization /
- nodulation /
- gene expression
-
氮是植物生长必需的大量营养元素,但植物在生长过程中无法直接利用空气中的氮气和土壤中积累的绝大部分有机氮(氨基酸除外),导致氮素成为限制植物尤其是农作物生长发育的重要因素之一。生物固氮过程可将大气中的惰性氮(N2)转化为植物能够直接吸收利用的氮素,减少了植物对氮肥的依赖,且其提供的氮在原位利用时不易淋溶和挥发[1],具有绿色、安全、稳定、高效的特点[2],因此生物固氮成为了研究者们的重要研究方向。据估计,全球范围内生物固氮每年约产生2亿t氮[3−4],农田中近50%的氮由固氮微生物贡献[5]。
生物固氮按照固氮微生物和植物的关系分为自生固氮、共生固氮和联合固氮3种类型。共生固氮是自然界中最有效的固氮方式,共生固氮系统需要固氮菌特异性地侵染宿主植物以诱导固氮器官的形成,这一过程由共生伙伴之间高度复杂的信号网络介导[6−10]。参与共生固氮的微生物包括能与豆科植物共生的根瘤菌以及能与非豆科植物共生的弗兰克氏菌,其中根瘤菌−豆科植物共生固氮体系每年固定的氮量约为5500万t,约占陆地生态系统每年生物固氮总量的一半[11−12]。根瘤菌种类繁多且对宿主的选择专一性不同[13−14],相比而言,非豆科植物共生固氮菌弗兰克氏菌固氮效率较高且共生专一性较弱,共生宿主更为广泛[15],因此弗兰克氏菌在非豆科植物的固氮研究中具有重要的潜力和价值。但目前发现的弗兰克氏菌的宿主植物大都为木本科植物[16],在禾本科植物中的研究有待深入。联合固氮是固氮菌定殖在植物根、茎或叶中的一种无特殊共生结构的固氮系统,其对于维持禾本科植物氮素营养以及降低化学氮肥投入具有重要意义[13−14, 17],如水稻和玉米可通过联合固氮满足其20%~25%的氮素需求[18],甘蔗体内的固氮菌可为甘蔗提供60%的氮素[19]。但是联合固氮体系中的微生物与植物根系之间的联合并未形成根瘤等共生结构,使其容易受到根际不良环境如干旱、盐碱等以及氧、铵、温度等的影响,固氮效率不稳定[20]。提高根际联合固氮的效率,扩大根瘤菌的宿主范围对于农业生产有重大意义[21−24]。自生固氮是各种自由生活、与植物没有依存关系且能独立固定氮气的固氮系统,固定的氮素只有在微生物死亡后才能通过氨化作用被植物吸收利用,对于土壤中氮的保存具有重要作用。
固氮菌除了可以通过固氮、溶磷、解钾等作用改善植物根际营养外[25−26];还可以产生铁载体[27]、植物激素类物质或各种酶等促进植物生长发育[28−29];在不利环境下,可以通过与病原菌竞争、诱导宿主系统反应、促进植物提高根际营养成分和营养循环来抵抗各种生物和非生物胁迫[30−31]。在现代化农业生产中,有效利用具有多种功能和促生特性的固氮菌株,在提高作物生产力、提升土壤肥力的同时,还能降低过度施肥带来的污染风险[31],促进农业可持续发展和环境保护。近些年,随着遗传工程、宏基因组、转录组和代谢组等方法的应用,生物固氮领域的研究逐渐深入。1972年,第一个人工固氮大肠杆菌创建[32],为人工固氮体系的农业应用奠定了重要理论基础与技术支持;1997年,世界首例投入田间应用的基因工程固氮菌产品—转dctABC/nifA基因的重组苜蓿根瘤菌在美国被批准有限商品化生产[33];2001年,苜蓿中华根瘤菌完成全基因测序[34],标志着生物固氮研究进入组学和基因工程研发的新阶段。据燕永亮等[20]报道,已有600多种固氮微生物及400多种豆科植物完成了全基因组测序,为固氮基因的网络调控以及分子机理的揭示搭建了更完善的平台。探索固氮菌的定殖机制、固氮酶的作用机制等,对实现固氮菌高效固氮、推进生物固氮的应用、减轻和缓解农作物对工业氮肥的依赖、实现绿色农业和助力发展农业新质生产力等具有重要意义。
1. 材料与方法
1.1 数据来源
数据来源于美国汤森路透公司Web of Science (WOS)核心合集数据库和中国知网(CNKI),英文检索词设置为(“biological fixation of nitrogen”) OR (“biological nitrogen fixation”) OR (“nitrogen-fixing microorganism*”) OR (“BNF”);中文检索词设置为“生物固氮”。检索时间限定为1990−01−01至2023−12−31,所有文献的检索日期为2024−04−30,英文文献选定类型为Article和Review,中文文献类型为学术期刊和学位论文。检索时英文的双引号(“ ”)是将词组作为一个整体进行检索,可提高准确性;星号(*)表示任何字符组,包括空字符,如microorganism和microorganisms。共获得英、中文文献分别为9298、2611篇。
1.2 研究方法
在WOS核心合集数据库和CNKI中检索到文献,每次下载500篇,选择文献全记录与引用的参考文献文本文件。利用VOSviewer软件中的合作作者(Co-authorship)网络分析生物固氮研究国家(Countries)、机构(Institution)之间的合作关系[35],国家和机构发文量阈值分别设置为80、55,中文机构阈值设置为10;合作网络图中圆圈大小表示对应国家/地区文章发表数量多少,连线疏密表示合作的密切程度,连线越密表明科研合作越密切[28]。同时,利用VOSviewer软件中的共现(Co-occurrence)网络分析生物固氮研究领域的重要关键词及其之间的共现关系。利用HistCite引文图谱分析工具中本地引用次数(total local citation score,TLCS)与总引用次数(total global citation score,TGCS)两个重要参数来确定生物固氮研究的主要学术期刊[36]。利用CiteSpace软件中的关键词突现(Burstness)来分析近10年生物固氮研究领域的热点演变。
2. 结果与讨论
2.1 发文数量与学科分布
由图1a可见,关于生物固氮的研究发文量逐年增加,表明了各国对于生物固氮这一研究领域的重视。根据WOS核心合集数据库,1990—2023年生物固氮相关研究英文发文量较多的国家有美国(2751篇)、中国(1372篇)、巴西(965篇)、德国(662篇)、英国(657篇)等。虽然生物固氮在中国的研究起步晚于美国、巴西等国家,但近10年来发文量增加很快(图1b),已成为WOS数据库中该领域发文数量第2的国家。由图1c可见,生物固氮研究涉及到多个学科和领域,英文发文量排名前5位的学科分别为植物科学(16%)、微生物学(15.1%)、土壤科学(13.1%)、环境科学(12.6%)、农艺学(11.8%)。中文发文量排名前5的学科有生物学(24.2%)、作物学(23.6%)、农业基础科学(17.7%)、农艺学(13.5%)、资源利用与环境科学(5.9%) (图1d)。虽然不同学科研究生物固氮的角度不同,但大部分研究侧重于提升土壤中可利用氮素的含量,促进植物的生长,此外还有部分研究关注于海洋固氮,其对于碳封存和调节全球气候变化有重要意义。
![]() 图 1 1990—2023年中英文期刊有关生物固氮的发文量(a)、中国研究对英文文献的贡献率(b)及WOS (c)和CNKI (d)数据库生物固氮相关研究发文量排在前10名的学科Figure 1. The number of literature on biological nitrogen fixation in Chinese and English from 1990 to 2023 (a), the contribution of Chinese researches to the English literature (b) , and the top 10 disciplines involved in biological nitrogen fixation researches based on data from WOS (c) and CNKI (d) databases from 1990 to 2023
图 1 1990—2023年中英文期刊有关生物固氮的发文量(a)、中国研究对英文文献的贡献率(b)及WOS (c)和CNKI (d)数据库生物固氮相关研究发文量排在前10名的学科Figure 1. The number of literature on biological nitrogen fixation in Chinese and English from 1990 to 2023 (a), the contribution of Chinese researches to the English literature (b) , and the top 10 disciplines involved in biological nitrogen fixation researches based on data from WOS (c) and CNKI (d) databases from 1990 to 20232.2 发文的主要国家与机构
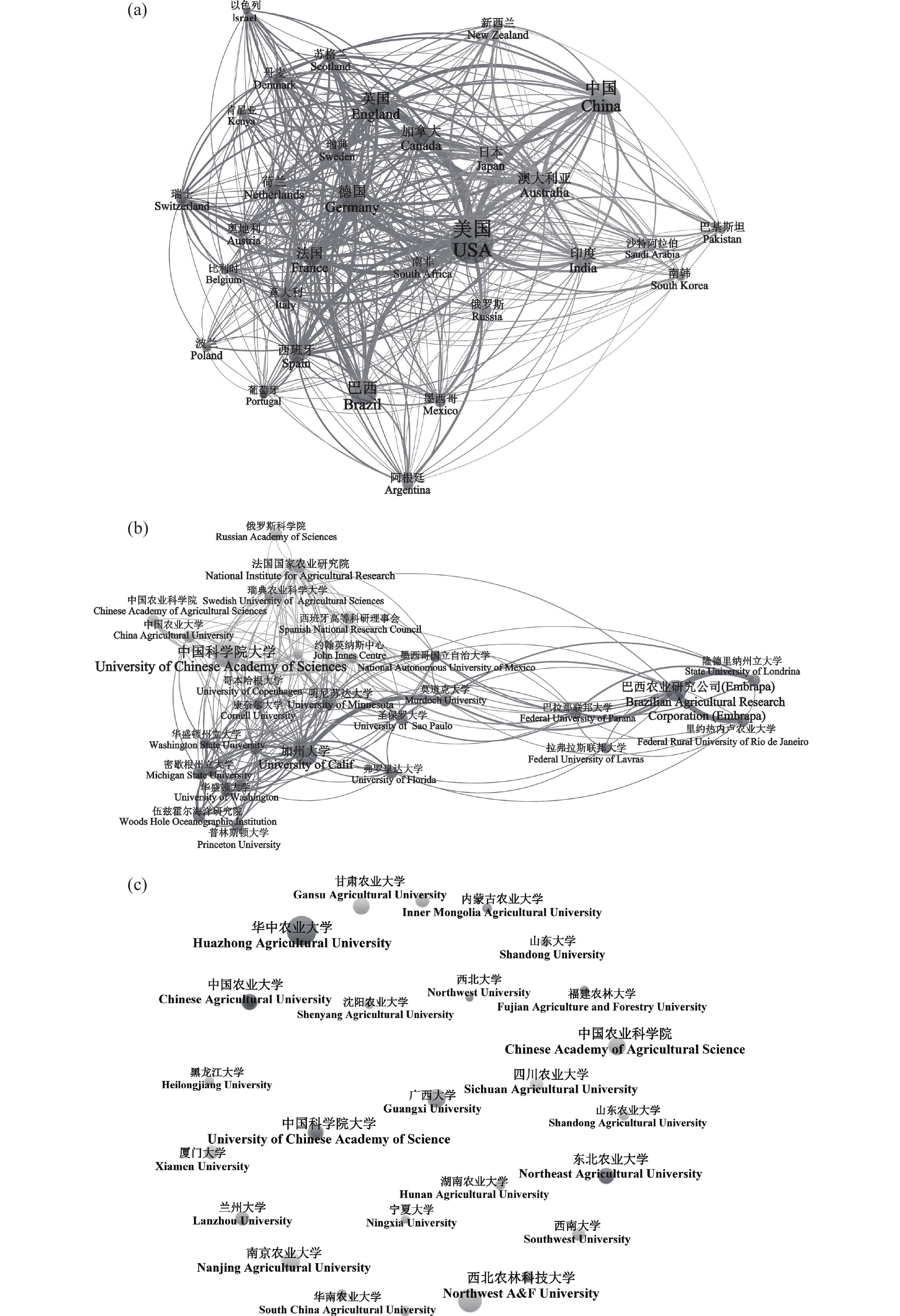
VOSviewer共同作者(Co-authorship)合作网络分析结果表明,生物固氮研究领域国际合作密切的国家有美国(总联系强度TLS 1727)、德国(TLS 840)、英国(TLS 811)、中国(TLS 761)、澳大利亚(TLS 733)等(图2a)。由世界各机构合作分析网络可见,TLS排名前3的机构为巴西农业研究公司(TLS 164)、加州大学(TLS 137)、伦敦大学(TLS 80)。中国与其他机构合作较多的研究机构有中国科学院大学(TLS 70)、中国农业大学(TLS 44)、中国农业科学院(TLS 25),合作较为密切的外国机构主要包括哥本哈根大学、瑞典农业科学大学、约翰英纳斯中心等(图2b)。但中文发文分析结果表明,国内各机构之间合作较弱(图2c)。
![]() 图 2 生物固氮英文和中文文献的产出国家或者主要机构间相关合作关系网络注:(a)图为英文文献主要产出国家之间的联系,(b)图为英文文献主要产出机构间的联系,(c)中文文献主要产出机构间的联系。其中(a)、(b)图中圆圈的大小代表发文量的多少,曲线的粗细代表合作强度的强弱。Figure 2. Collaborative networks among the contributor countries or major institutions that published biological nitrogen fixation papers in English or ChineseNote: Figure (a), the network between countries contributing papers in English. Figure (b), the network between institutions contributing papers in English. Figure(c), the network between institutions contributing papers in Chinese. In figures (a) and (b), the size of the circle represents the number of papers, and the thickness of the curve represents the strength of the collaboration.
图 2 生物固氮英文和中文文献的产出国家或者主要机构间相关合作关系网络注:(a)图为英文文献主要产出国家之间的联系,(b)图为英文文献主要产出机构间的联系,(c)中文文献主要产出机构间的联系。其中(a)、(b)图中圆圈的大小代表发文量的多少,曲线的粗细代表合作强度的强弱。Figure 2. Collaborative networks among the contributor countries or major institutions that published biological nitrogen fixation papers in English or ChineseNote: Figure (a), the network between countries contributing papers in English. Figure (b), the network between institutions contributing papers in English. Figure(c), the network between institutions contributing papers in Chinese. In figures (a) and (b), the size of the circle represents the number of papers, and the thickness of the curve represents the strength of the collaboration.2.3 主要发文期刊与学者
在生物固氮研究领域中,英文发文量排在前5名的期刊主要集中在植物科学和微生物学领域,而中文文献发文量前5名的期刊主要集中在植物科学和农学领域(表1)。其中,《Plant and Soil》、《Soil Biology & Biochemistry》期刊刊出的生物固氮论文的本地引用次数分别高达4230、1515次,表明这些论文在该研究领域的后续影响较大[37]。依据WOS和CNKI数据库,发文量排名前5的作者及其主要研究方向如表2所示。英文发文量最多的学者是Hungria M,其与发文量排名第2、3的学者Urquiaga S、Boddey R M来自同一个机构(Embrapa,巴西农业研究公司),Boddey R M还具有最高的本地引用次数(1690次)。中文发文较多的学者有李友国、李杨瑞、燕永亮等。
表 1 1990—2023年生物固氮研究发文量前5的期刊Table 1. Top 5 English and Chinese journals for biological nitrogen fixation research during 1990−2023期刊名称
Journal发文量
Number of paper2023年影响因子
Impact factor in 2023本地引用
Local reference (TLCS)总引用
Total reference (TGCS)Plant and Soil 333 3.9 4230 20236 Soil Biology & Biochemistry 195 9.8 1515 8640 Frontiers in Microbiology 179 4.0 906 6033 PLoS ONE 119 2.9 752 4480 Frontiers in Plant Science 118 4.1 990 5113 《生物技术通报》 Biotechnology Bulletin 53 1.335 51 372 《植物营养与肥料学报》
Journal of Plant Nutrition and Fertilizers27 3.282 143 1283 《大豆科学》 Soybean Science 27 1.314 48 600 《华中农业大学学报》
Journal of Huazhong Agricultural University26 1.767 27 225 《中国农业科学》 Scientia Agricultura Sinica 24 2.613 181 1498 表 2 WOS和CNKI数据库中1990—2023年生物固氮研究领域发文量排名前5的学者Table 2. Top 5 authors in number of papers published addressing biological nitrogen fixation in WOS and CNKI databases during 1990−2023作者
Author发文量
Number
of paper机构
Institution主要研究方向
Main research direction本地引用
Local
reference
(TLCS)总引用
Total
reference
(TGCS)Hungria M 132 巴西农业研究公司
Brazilian Agricultural Research
Corporation (Embrapa)植物生长促生菌接种对作物和土壤的影响
Effect of plant growth-promoting bacteria inoculation
on crops and soil1181 5452 Urquiaga S 65 施肥对生物固氮及其它营养元素的影响
Effect of fertilization on biological nitrogen fixation
and other nutrient elements1220 3862 Boddey R M 64 生物固氮对作物生产的影响 (N2丰度)
Effect of biological nitrogen fixation on crop production
(N2 abundance)1690 5178 Zehr J P 62 加州大学圣克鲁兹分校
University of California, Santa Cruz海洋固氮微生物群落
Marine nitrogen-fixing microbial communities1265 5601 Woyke T 55 劳伦斯伯克利国家实验室
Lawrence Berkeley National Laboratory生物固氮机理 (基因层面)
Biological nitrogen fixation mechanism (gene level)70 1225 李友国
Li Youguo51 华中农业大学
Huazhong Agricultural University根瘤菌共生固氮的分子机理及应用
Molecular mechanism and application of rhizobium
symbiotic nitrogen fixation27 183 李杨瑞
Li Yangrui33 中国农业科学院
Chinese Academy of
Agricultural Sciences甘蔗生物固氮
Biological nitrogen fixation in sugarcane63 697 燕永亮
Yan Yongliang22 固氮微生物基因组学、分子生物学等
Genomics and molecular biology of nitrogen-fixing
microorganisms, etc.33 212 杨丽涛
Yang Litao20 广西大学
Guangxi University甘蔗生物固氮
Biological nitrogen fixation in sugarcane35 388 王卫卫
Wang Weiwei19 西北大学
Northwest University共生固氮生态生理学及根际微生物多样性
Ecophysiology of symbiotic nitrogen fixation and
rhizosphere microbial diversity11 243 3. 研究现状及趋势
3.1 生物固氮的主要研究方向
文章的关键词是对于文章主要内容的凝练概括,某一关键词出现的次数越多表明相关主题越受研究人员重视。基于VOSviewer软件,选取文章中的高频关键词,构建生物固氮研究关键词共现网络(图3)。英文高频关键词主要有:biological nitrogen-fixation (生物固氮,4955次)、biodiversity (生物多样性,895次)、growth (生长,893次)、legumes (豆类,880次)、nodules (根瘤,858次)、soils (土壤,787次)等。中文关键词主要有生物固氮(377次)、豆科植物(269次)、共生固氮(266次)、根瘤菌(237次)、苜蓿 (78次)、结瘤 (77次)等。中文文献的大多数关键词囊括在英文文献中,在后续分析中以英文文献的关键词共现网络为主。根据关键词共现网络,英文文献中生物固氮相关研究可以划分为4个聚类,如图3所示,图中不同颜色代表不同聚类,也即不同的热点内容。而中文文献研究内容无明显聚类,但从关键词看,主要是关于生物固氮的机理与应用,与英文文献中的聚类2、3相关。图3a中关键词聚类1主要是关于固氮微生物及其定殖,关键词主要有:nodules (根瘤,858次)、rhizobacteria (根瘤菌,748次)、plants (植物,628次)、bacteria (细菌,608次)、plant-growth promoting rhizobacteria (PGPR,植物根际促生菌,494次)等。
固氮菌种类繁多,作为一种重要的植物根际促生菌,其定殖在作物根际后不仅对于作物的生长有促进作用,还兼具生物防治的功能。随着研究的不断开展,新的菌株被发现的同时,对于其功能的研究也在不断深入。关键词聚类2主要是关于生物固氮对于农业生产的影响,包括的关键词主要有:growth (生长,893次)、legumes (豆类,880次)、soils (土壤,787次)、yield (产量,441次)等,固氮菌定殖在作物根际后对作物的生长产生促进作用,生物固氮可以为作物提供一定的养分,并且在促进作物产量提高的同时也促进土壤肥力的提升,有利于可持续农业的发展。关键词聚类3主要是关于生物固氮分子机理的研究,包括的关键词主要有:expression (表达,648)、gene (基因,370次)、identification (识别,335次)、Escherichia coil (大肠杆菌,267次)、metabolism (代谢,233次)等。随着高通量测序、分子生物学等技术方法的进步,对生物固氮的研究逐渐深入,了解生物固氮的分子机理能更好地提升其在农业上的应用,对降低农业生产成本、保护生态环境、发展农业新质生产力等具有重要意义。关键词聚类4主要是生物固氮影响因素的相关内容,包括的关键词主要有:biological nitrogen-fixation (生物固氮,4955次)、biodiversity (生物多样性,895次)、nitrogen (氮,701次)、microbial communities (微生物群落,532次)、carbon (碳,487次)、phosphorus (磷,434次)、Cyanobacteria [蓝细菌(蓝藻),355次]、organic matter (有机质,306次)等,固氮微生物在发挥其功能的过程中受到很多因素的限制,如土壤中磷和钼元素的有效性、干旱、盐碱胁迫、施肥管理等,减少外界不利因素对生物固氮的影响,对提高生物固氮效率具有重要意义。
3.2 生物固氮的研究进展及其分类概述
结合生物固氮领域的关键词共现网络(图3)、近10年的突现指标(图4)及高被引文献(表3),对生物固氮的研究重点及进展进行归纳总结。
表 3 高被引文献基本信息Table 3. Basic information of highly cited papers标题
Title第一作者
The first author发文期刊及年份
Journal and year of publication本地引用
Local
reference
(TLCS)总引用
Total
reference
(TGCS)Global inputs of biological nitrogen fixation in agricultural systems Herridge D F Plant and Soil,2008 342 995 Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems Cleveland C C Global Biogeochemical Cycles,
1999233 691 Genetic regulation of biological nitrogen fixation Dixon R Nature Review Microbiology,2004 217 728 Nitrogen cycles: past, present, and future Galloway J N Biogeochemistry,2004 212 3735 Nitrogenase gene diversity and microbial community structure: a cross-system comparison Zehr J P Environment Microbiology,2003 208 710 中国氮肥发展、贡献和挑战
The development and contribution of nitrogenous fertilizer in China
and challenges faced by the country张卫峰
Zhang Weifeng中国农业科学
Scientia Agricultura Sinica 201349 490 土壤微生物在促进植物生长方面的作用
Effect of soil microbes on plant growth吴建峰
Wu Jianfeng土壤 Soils,2003 25 488 土壤氮素转化的关键微生物过程及机制
Key processes and microbial mechanisms of soil nitrogen transformation贺纪正
He Jizheng微生物学通报
Microbiology China,201349 489 间套作强化农田生态系统服务功能的研究进展与应用展望
Intercropping enhances agroecosystem services and function: Current
knowledge and perspectives李隆
Li Long中国生态农业学报 Chinese Journal of Eco-Agriculture,2016 47 327 中国生物固氮研究现状和展望
Research status and prospect of biological nitrogen fixation in China沈世华
Shen Shihua科学通报
Chinese Science Bulletin,200316 309 3.2.1 生物固氮微生物及其定殖
微生物是驱动土壤元素生物地球化学循环的引擎。土壤微生物与植物的根系形成一个稳定的动态平衡,二者相互影响、相互作用。植物的根系为土壤微生物提供养分,土壤微生物反过来也促进了植物根系的发育,从而促进植物的生长[38]。合理利用土壤微生物的促生特性,充分发挥土壤微生物的优势,对促进植物生长、提高作物产量及发展农业新质生产力等具有重大意义。在土壤生态系统中,能进行固氮的原核微生物可以独立生存,也可以与植物互利共生[39]。固氮细菌具有nifH基因,用于编码固氮酶的结构成分,在固氮过程中发挥关键作用[40]。固氮细菌在系统发育上是多样化的,广泛分布于厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)等菌门中。
固氮菌作为植物根际促生菌,其在植物根部定殖情况是影响田间固氮效果的重要因素之一,也是研究者们关注的重点。微生物在植物根际定殖受多种因素影响,其中各种根系分泌物在固氮菌定殖过程中发挥着重要作用,固氮菌可通过趋化性和运动性来感知各类分泌物并向植物根际迁移,之后形成生物膜实现有效定殖[41]。具体定殖情况可以通过荧光标记法、共聚焦激光扫描显微镜等观察[42]、活菌计数法等方法来判断。关于菌株定殖机理研究已取得了一些进展,但由于根系分泌物种类繁多、变化多样且根际环境十分复杂,定殖情况很难得到清晰解析。因此,深入探究菌株的定殖机制并积极推进根际促生菌在农业生产中的应用极具意义。
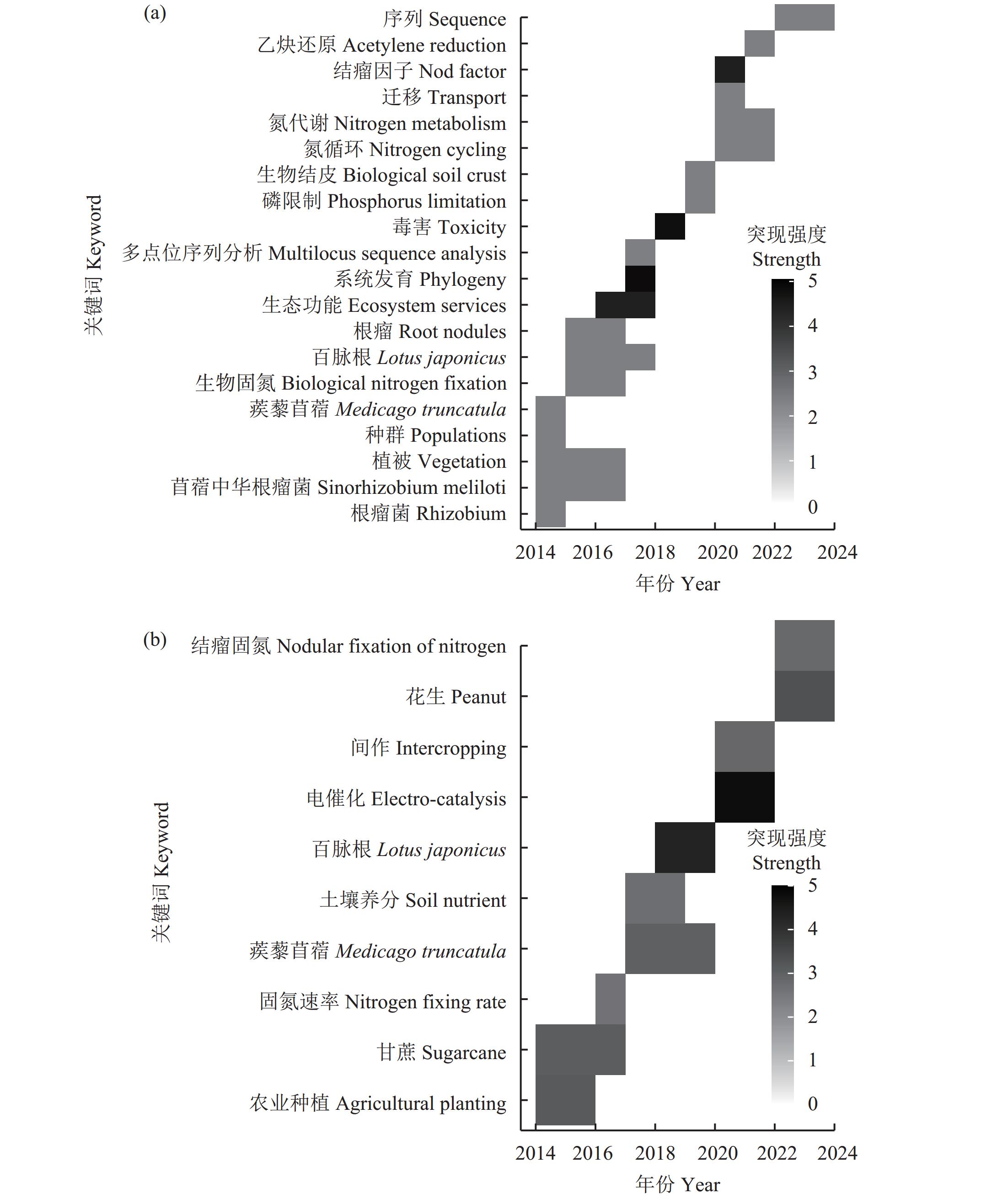
综合图3和图4可见,根瘤菌−豆科植物作为生物固氮的重要体系对于农业生态系统有着重要价值,中英文文献中豆科植物如紫花苜蓿(5.18)、蒺藜苜蓿(3.03)、结瘤固氮(2.84)、根瘤菌(16.96)等关键词的突现强度较高,代表这些主题在短时间内被广泛关注研究。不同根瘤菌选择宿主的专一性不同,例如,Sinorhizobium fredii NGR234宿主较广,可以与大豆(Glycine max)、豌豆(Cajanus cajan)和豇豆(Vigna unguiculata)等120个属的豆科植物结瘤共生固氮[13]。而Rhizobium leguminosaru对宿主的选择极为严格,只能与三叶草(Trifolium spp.)结瘤固氮[14]。弗兰克氏菌−非豆科植物作为共生固氮的另一体系在生物固氮的研究应用中也发挥着重要作用,弗兰克氏菌共生专一性不强,能与270多种非豆科植物结瘤共生,如沙棘、红桤树等,因此在非豆科植物共生固氮研究中极具潜力。土壤微生物如丛枝菌根真菌(AMF)可通过直接或者间接作用促进生物固氮,通过其菌丝网络,AMF可促进共生固氮菌在豆科植物根系的定殖[43],以及在相似或者不同植物之间转移养分和固定氮素[44−45]。非共生固氮体系在农业生产中也发挥着较大的固氮潜能。在一些农田,禾谷类作物可以从非共生固氮微生物中获得1/4~1/3的供氮量[5]。微生物组学研究表明,大量的根际和内生固氮菌定殖于玉米和水稻[46]等主要谷类作物。应用合成生物学的原理改造禾谷类作物根际微生物群中的固氮菌,提高微生物的固氮效率,或许可以减少一半的化学氮肥施用[8]。Azospirillum作为一种异养的固氮菌,可以与禾本科作物如水稻、甘蔗等进行联合固氮,研究较多的有A. brasilense、A. lipoferum和A. amazonense等[47]。草螺菌属(Herbaspirillum)、伯克霍尔德菌属(Burkholderia)、假单胞菌属(Pseudomonas)等中也有部分菌株具有固氮能力[48]。据报道,在粮食作物玉米上接种假单胞菌和巨大芽孢杆菌等固氮细菌,可以产生与添加33%的氮肥相同的玉米干重和叶绿素含量[49]。Azotobacter属中的固氮菌都具有较强的固氮能力,其作为一种好氧固氮菌,在土壤中能独立于植物进行自生固氮。其它菌属,如拜叶林克氏菌属(Beijerinckia)、梭菌属(Clostridium)等也可进行自生固氮[50]。
3.2.2 生物固氮对农业生产的影响
关键词共现网络图3a中,biological nitrogen-fixation (生物固氮,4955次)、growth (生长,893次)、legumes (豆类,880次)等出现频次较多,且生态功能(4.42)、农业种植(3.15)、土壤养分(2.73)等关键词的突现强度也较高(图4),体现了生物固氮研究与农业生产紧密关联。土壤作为植物生长发育的场所,需要为植物提供生长所需的基础物质,土壤中虽然含有大量的有机氮,但却不能被植物直接利用,因此氮成为了限制农业发展的重要因素之一。为了提供作物生长足够的氮素营养,工业氮肥施加成为一种快捷、有效的方式,氮肥的施用能在短期内快速为作物提供养分,但氮素在土壤中是一种极易流失的营养元素,硝态氮的淋溶、氨氮的挥发、微生物反硝化作用[51]等都会造成氮损失[52],对生态和环境造成负面影响[53−54]。因此,减少对大量化肥的依赖,以提高农业作物产量,显得尤为重要。生物固氮是固氮微生物将大气中的氮气还原成氨的过程,具有安全、绿色、稳定等特点,与工业固氮相比,生物固氮不仅为作物提供了清洁、高效的氮素营养,还可以改善土壤结构、提升土壤肥力、引起微生物群落的积极变化[21, 26−27],因此成为了研究者解决作物生长对氮肥依赖的重要研究方向。
固氮微生物通过直接作用和间接作用来促进植物生长,直接机制主要包括N2的生物固定、磷钾的溶解、ACC (1-氨基环丙烷-1-羧酸)脱氨酶的产生、植物激素的合成、铁载体的产生等,间接机制主要包括生物防治、抗生素的产生等[55]。目前,共生固氮和联合固氮已投入农业生产应用。大豆根系与根瘤菌共生结合固定的氮素在其生长、发育和成熟阶段都有显著贡献。据报道,大豆荚果和籽粒中有55%的氮来自植株共生固氮[56]。在水稻、甘蔗、玉米、小麦等植物的生长中,联合固氮也发挥着重要的作用,如甘蔗根际微生物每年可以固定100 kg/hm2氮素[57],极大促进了植物对氮素的利用;接种自生固氮菌Azotobacter可显著减少水稻氮肥施用量且对产量无显著影响[58]。磷是仅次于氮的第二大限制性植物养分,在植物代谢中起着主要作用,但土壤中的磷大多数以不溶的复合态存在,许多土壤微生物通过酸化、螯合、络合、交换反应等,来溶解土壤中的无机磷酸盐或者通过分泌各类酶来分解有机磷,一些固氮菌也以其溶磷能力而闻名,如Azotobacter属等[59]。研究表明,Azotobacter vinelandii能够溶解埃及阿布山磷矿中高达43%的磷[25]。也有研究表明,固氮菌Azotobacter的胞外多糖是溶解磷酸三钙的主要因素[60]。固氮微生物大多可以产生植物激素,如生长素、细胞分裂素、赤霉素、乙烯等。生长素是调节植物生长发育的基本植物激素,其参与根瘤菌的侵染过程,可以增加植物参与养分吸收的侧根和根毛的数量[61],在细胞分裂、伸长、果实发育和衰老中起着核心作用,豆科植物结瘤比未结瘤的根含有更多的生长素[62]。另外,细胞分裂素也可促进根瘤的形成,赤霉素、乙烯等可以调控根毛侵染及根瘤发育过程[63]。各类激素间也相互作用,例如植物体内生长素和细胞分裂素过量会诱导乙烯生成,引起植物免疫反应,从而抑制根瘤的发育。许多固氮菌株属于根瘤菌属(Rhizobia)、慢生根瘤菌属(Bradyrhizobia)、剑菌属(Ensifer)、固氮菌属(Azotobacter)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)和芽孢杆菌属(Bacillus)等,它们可以通过产生植物激素、次生代谢产物等促进鹰嘴豆、豆类、豌豆、小麦和水稻等的生长,提高产量[29]。
固氮微生物与植物可以通过多种机制消除外界胁迫,适应不良环境。如根瘤菌在植物防御系统中发挥重要作用,它可以通过与细菌、真菌、病毒等植物病原体竞争食物、生态位以及合成抗真菌代谢产物和诱导系统抗性(ISR)等方式来消除外界胁迫[64−65]。2022年《Science》期刊上发表的一项研究发现,大豆根瘤中的新型能量感受器GmNAS1/GmNAP1可以通过调控根瘤碳源的重新分配,进而调整根瘤固氮能力的分子机制[66],这一机制使豆科植物生长环境发生变化时可以依据其体内碳源的可用性及时调整根瘤固氮效能,进而维持植物体内的碳氮平衡,适应环境的变化。部分固氮菌耐盐菌株能够在植物根际定殖并在逆境条件下促进植物生长,提高植物对各类胁迫的耐受性[30]。研究发现,在盐胁迫条件下,固氮菌株和小麦混合使用可以促进小麦生长[67];玉米植株接种固氮菌后,可以提高玉米对钠的排除和钾的吸收并改善植物生长[68−69]。此外,固氮微生物自身也可以分泌一些物质来抵御不利因素[70]。如根瘤菌还可以产生抗生素,通过分泌一些低分子量的毒素来阻止其他微生物的生长[71−72],促进根瘤菌的定殖进而增强植物的抗逆性。固氮微生物产生的胞外聚合物(EPS)可以在干燥条件下维持细胞水分,还能够直接结合并吸收污染土壤中的重金属镉和铬[73],缓解重金属污染。许多固氮菌可以产生色素,并在固氮过程中发挥重要作用,如Azotobacter. chroococcum在生物固氮期间会形成深褐色水溶性色素黑色素,保护固氮酶系统免受氧气的伤害[25]。
3.2.3 生物固氮的分子机理
生物固氮可以通过不同的作用机制改善根际土壤微生物群落多样性,刺激植物根系的代谢活动,直接或间接地对根际土壤和植物产生促进作用[74]。不同类型的固氮菌均能生物固氮,是因为其体内存在一种具有特殊功能的蛋白质——固氮酶,固氮酶的结构、调控基因[40]、酶活性等对固氮功能有着重要影响[75]。Ohki等[76]在《Nature》上发文揭示了位于合成的[Mo3S4Fe]立方体中的铁原子可以结合并还原氮气,为固氮分子机制的研究提供了新线索。固氮酶是一种可以催化分子氮还原为氨的复杂金属酶,根据活性位点辅因子结合金属(钼、铁、钒)不同,固氮酶分为3种,自然界中所有的固氮菌均能产生钼固氮酶,但是有些固氮菌除了产生钼固氮酶外,还产生钒和铁固氮酶[77−78]。其中nifD和nifK基因可编码钼铁固氮酶,nifH基因可编码铁蛋白(固氮还原酶)[79−80],而nifA、nifB、nifE、nifN、nifQ、nifS、nifV、nifW、nifX和nifZ等nif基因在电子转移及铁、钼辅因子生物合成等过程中发挥作用[81]。3种固氮酶中,以钼为金属配体的固氮酶固氮活性最高,钼元素的含量和有效性是生物固氮的重要限制因子[82−83]。除固氮酶外,参与固氮作用的多个调控蛋白均由nif基因编码,这些蛋白在许多固氮菌中具有相似的序列和共同的结构与功能。固氮酶对氧气极其敏感,只能在微氧或者无氧条件下才能发挥其功能,固氮基因nif的转录也受到外界氧气的严格调控。氧气会使固氮酶失活[1]。相比而言,铁固氮酶和钒固氮酶对氧气特别敏感,钼固氮酶对氧气稍不敏感[84]。研究发现,嗜热自养链霉菌(Streptomyces thermoautotrophicus)具有耐氧的固氮酶[85],但该系统的最佳固氮条件为高温,其中可能涉及到其它的反应。为了保护固氮酶免受氧损伤,固氮菌在进化过程中逐渐形成了氧保护机制,如呼吸保护、构象保护等。
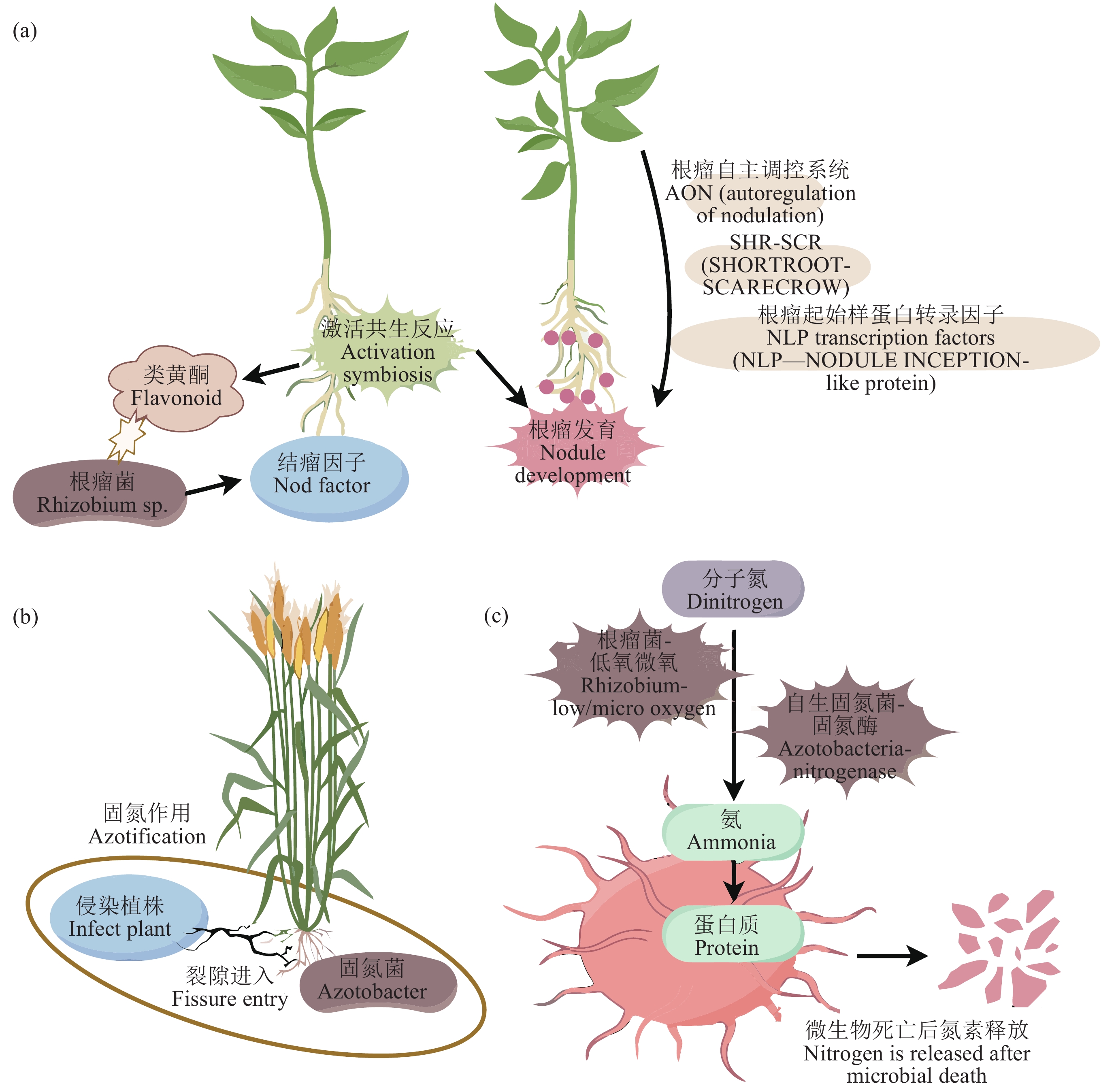
由图4可看出,豆科植物百脉根(Lotus japonicus)和蒺藜苜蓿(Medicago truncaluta)作为关键词在中英文文献中随时间有着不同程度的突现,作为模式豆科植物,二者基因组较小、生长周期短,并且已建立了完善的遗传转化体系,可作为生物固氮理论研究的重要材料。依托于良好的研究材料,共生固氮作用机理研究已较为透彻,共生固氮系统需要根瘤菌特异性感染寄主植物来诱导固氮器官的形成,这一过程是由共生伙伴之间高度复杂的信号网络介导的[7, 9]。豆科植物和根瘤菌之间的共生始于双方分泌的信号分子的相互识别(图5a):低氮条件下,豆科植物根系通常会向土壤中释放特定的类黄酮,根瘤菌受到类黄酮诱导产生结瘤因子,该信号被宿主豆科植物根部感知,激活共生反应诱导植物根中形成侵染线,这种侵染线有利于根毛细胞和邻近皮层细胞的渗透,导致根瘤原基的形成,启动固氮根瘤的发育[86−87]。大豆和根瘤菌在进化过程中,根瘤菌从裂隙侵染向根毛侵染方式转化的遗传、分子和进化机制[88]的转变,对于增强大豆共生固氮能力和提高大豆产量起到了重要作用。随着根瘤的成熟,细菌被包围在共生体膜内,经历微氧环境分化为类菌体,利用固氮酶复合物[89]即可固定扩散的氮气。适当的根瘤数能提高豆科植物的氮素利用效率,豆科植物可通过地上−地下长距离信号传导,形成根瘤数自主调控系统AON来调控根瘤数量[90],在这一过程中通过各种信号分子来确保结瘤过程顺利进行,为豆科作物结瘤固氮提供了重要保障。此外,2020年《Nature》文章研究揭示,SHR-SCR (SHORTROOT-SCARECROW)分子调控模块可以通过皮层细胞来调控豆科植物根瘤起始的分子机制,使其有别于非豆科植物,这可能是豆科植物实现共生结瘤固氮的前提,该分子模块过量表达可诱导皮层细胞分裂形成根瘤状结构[91]。NLP (NIN-like protein根瘤起始样蛋白)转录因子作为一个关键枢纽基因,在豆科植物结瘤共生中也发挥着整合结瘤信号和植物激素信号的核心作用[92]。河南大学王学路团队于2021年在《Science》上发文,揭示了光驱动豆科植物根部共生固氮的分子机制[93],光信号可以通过CCaMK-STF-FT这一模块整合地上光信号和地下根瘤的信号通路来调控根瘤形成,使宿主植物的根能够感知地上环境是否能可持续地为地下共生固氮提供必需能量,从而开启根部共生结瘤[93]。
与共生固氮体系不同,在缺氮但能量充足的情况下,根际土壤微生物和植物根系会联合形成相应的固氮体系,联合固氮菌定殖在植物根表和近根土壤中,和植物根系松散的联合在一起但并未形成类似根瘤的结构(图5b)。联合固氮菌在禾本科等植物中应用时,一些固氮菌株可以借助植物的侧根生长或其它微小的结构裂缝进入根部(“裂隙进入”),定殖在植株的木质部或薄壁细胞进行固氮作用[94],例如通过侵染甘蔗、甘薯等植物的木质部薄壁组织进行固氮作用[95]。自生固氮微生物在土壤中能够独立进行固氮的过程,如圆褐固氮菌、梭菌、固氮蓝藻等,可以在固氮酶的作用下将分子氮转化为铵后合成氨基酸并组成蛋白质,但该情况下固定的氮素只有在固氮微生物死亡后才能被植物吸收利用(图5c)。在低氧或者微氧情况下,某些生长缓慢的根瘤菌也可能表现出自生固氮作用[96]。
3.2.4 生物固氮的影响因素及海洋生物固氮
生物固氮受到很多环境因素的影响,如图3、4中出现的氮(nitrogen)、磷(phosphorus)、钼(molybdenum)等营养元素以及温度(temperature)、水(water)等外界环境因素等。生物固氮存在“氮阻遏”现象,高浓度的外源氮对于生物固氮具有明显的抑制作用[97]。研究发现,外源氮的供应对于豆科植物根瘤数量、根瘤形态、植物固氮能力、作物的吸收利用效率以及氮素积累有较大的影响[98],其中不同的氮素浓度、氮素形态[99]、氮素施用时期[100]等都对豆科植物的结瘤特征产生不同的影响,化学氮肥过量施用会明显抑制豆科作物的生物固氮,而低氮有利于诱导根瘤菌结瘤因子基因的表达及根瘤菌的侵染和定殖[101]。但共生结瘤过程如何感知土壤中的氮素浓度变化并作出反应来控制结瘤的数量、大小和结瘤固氮的能力仍需进一步研究,揭示外源氮对根瘤固氮的调控机制,解析根瘤固氮与外源氮的协同效应,对发挥生物固氮潜力具有重要意义。对于非共生固氮,研究表明长期施用氮肥会使得联合固氮菌多样性降低[102−103]。当土壤中可利用的氮素能够满足植物需求时,则不需要生物固氮来提供额外的氮素,少量氮肥施用对联合固氮菌多样性影响不大,但大量氮肥的施用会显著降低联合固氮菌多样性[104]。生物固氮需要消耗大量的能量,磷作为植物生长发育的必需营养元素,并且是ATP的重要组成成分,对于氮代谢有着重要影响[105]。磷素不足会导致豆科植物根瘤发育迟缓、固氮能力减弱[106],施用磷肥后豆科植物的根瘤数量、干重和固氮能力都会有所提升[107],但是磷肥的施用要在一定范围内,过量会抑制根瘤活力,影响植物生长[108]。在恢复草场中施用磷肥也会显著增强土壤的生物固氮作用,增加有效氮含量[109]。草地养分添加试验发现,磷有效性对固氮菌多样性和群落组成的影响比氮更加显著,添加磷可以显著增加固氮菌的多样性,并可能促进某些联合固氮菌发挥作用[110]。生物固氮通常受到土壤中有效磷低的限制,研究发现在富磷土壤中,生物固氮似乎仅受钼的限制,而在贫磷土壤中受到钼和磷的协同限制[111];也有研究表明,磷和钼对生物固氮的限制是一个动态过程,磷可能在植物生长的早期限制生物固氮,而钼是植物生长中期生物固氮的限制因素[83]。微量元素铁、钒等作为固氮酶的必需元素,也是生物固氮的重要限制因素。除此之外,土壤的理化特性(如pH、有机质、水分等)以及农业管理方式和气候变化等对生物固氮也有一定的影响。
在聚类4中也出现了与海洋固氮相关的关键词,如浮游植物(phytoplankton)、蓝藻(cyanobacteria)、束毛藻属(Trichodesmium)等,生物固氮在海洋氮循环中也发挥着重要作用[112],并可能影响海洋生物封存大气二氧化碳的能力[113],研究海洋固氮及其中的氮循环对于预测全球环境变化对海洋生物、化学的影响具有重要意义[114−115]。2021年Wiebke Mohr课题组研究发现,生活在贫营养地中海中的海草(P. oceanica)根组织中具有能固氮的海洋细菌[116],其与海草形成类似于豆科植物−根瘤菌的共生固氮系统,在氮限制情况下可发挥其功能。2024年《Science》的一期封面研究文章,揭示了海藻体内某种具有固氮功能的细菌性内生体正在演变为一种固氮细胞器——硝化质体(Nitroplast)[117],其可以帮助海藻在氮限制的水域中生存,生物固氮不再是原核细胞的特有能力,真核细胞也可以通过Nitroplast来进行氮固定。固氮蓝藻是海洋中最主要的固氮生物[118],而束毛藻是最主要的固氮蓝藻,估计其可贡献高达50%的全球海洋总固氮量[119]。在贫营养环境中,固定的氮可有效缓解上层海洋的氮限制[120],对二氧化碳的净吸收也有重要作用[121]。一般固氮蓝细菌可通过形成异形胞将固氮作用与其他反应区分开,从而避免固氮酶接触氧气而损伤,其中束毛藻在进化中形成了一套独特的氧保护机制,在海洋生物固氮中极具独特性和代表性。2024年《Nature》期刊报道,海洋中除了蓝细菌,还存在能够与硅藻共生固氮的根瘤菌目细菌(Rhizobiales)[122],这一固氮体系也是海洋固氮的重要组成部分,在全球氮循环中也发挥重要作用。
4. 生物固氮的研究展望
2014—2023这10年间,genetic expression (基因表达)、bacterial community (细菌群落)、genetic diversity (遗传多样性)、abundance (丰度)等均具有较高的突现强度(图4),关键词共现网络中diversity (多样性)、rhizobacteria (根瘤菌)、expression (表达)等也多次出现(图3)。可以看出,随着宏基因组测序、转录组学、代谢组学、基因工程等新技术的不断发展和广泛应用,国内外生物固氮的研究已进入一个新的阶段,在《Nature》、《Science》、《Cell》等期刊上亦有许多最新的前沿报道[31, 66, 76, 91−93, 113, 115−116, 122−127]。如2020年以来,《Science》多次发文报道了根瘤菌和豆科植物相互作用的分子机理,如结瘤过程中不同信号分子的功能、传递与识别等。Bozsoki等[123]以豆科模式植物百脉根为研究材料,开展关于赖氨酸基序(LysM)受体如何识别特异配体的研究,为改造非豆科植物使其能识别根瘤菌提供了重要的理论指导。研究发现根瘤共生转录因子NIN (NODULE INCEPTION根瘤起始)水解后产生的羧基末端NIN片段,能够激活一系列与共生体发育和固氮相关的基因,从而促进根瘤进入固氮状态[124];NIN样蛋白转录因子NLP家族成员NIN和NLP2,通过直接结合豆科植物中保守的双重硝酸盐响应元件,来激活根瘤中豆血红蛋白基因的表达,平衡固氮所必需的氧气微环境[92],表明NLP-血红蛋白模块与缺氧生存的作用在根瘤中得以延续,解决了生物固氮的氧气悖论问题。此外,植物根系分泌物组成可影响土壤微生物群落和各营养元素的有效性,尤其是氮元素[128],并且有助于根际周围微生物种群的选择,招募更有利于植物生长的微生物[129],根际固氮菌对根系分泌物的趋化作用在禾本科生物固氮中发挥着重要作用[130]。研究根系分泌物与固氮菌的互作,并利用基因工程调控植物的代谢途径使其分泌更多有利于固氮菌的化合物如黄酮类化合物[131]、香豆素类代谢物等[132],可以显著提升固氮菌的活性和固氮酶的效率[132−133]。近年来,利用CRISPR基因编辑技术敲除/敲入基因可以精准创建基因的功能突变,明确在生物固氮过程不同阶段发挥作用的调控因子[134−135],进而增加所需信号分子的生物合成和分泌。如对水稻植株进行基因改造可以增加土壤N含量并提高作物产量,同时也证明可以通过操纵谷类作物的类黄酮生物合成途径来改变土壤中的生物固氮[133]。因此,系统解析根瘤菌的广谱结瘤和高效固氮机制,深入挖掘根瘤菌和豆科植物结瘤固氮的分子作用机制,进而扩大根瘤菌宿主范围、增强生物固氮体系的稳定性和固氮效率,将为生物固氮广泛应用到农业生产中提供支持。
联合固氮不能形成根瘤等共生结构,易受外界因素影响,固氮效率低下,这在很大程度上限制了联合生物固氮在农业生产中的应用。而共生固氮效率高,但宿主仅限于豆科植物,特异性强,如何将共生固氮作用从豆科植物转移到小麦、玉米、水稻等非豆科植物中发挥作用是生物固氮的一个重要研究方向。目前已经确定了具有固氮能力的土壤微生物的种类、影响固氮菌定殖的各种因素[136−138]以及编码固氮酶的基因[23]。其中,nifH、nifD、nifK、nifE、nifN等固氮酶基因的测序和2012年nif数据库的建立[139],使得固氮酶的进化历史更为明晰。若将豆科植物根瘤共生发育所必需的基因转移到禾谷类作物中,进而建立禾谷类植物与固氮菌之间的共生固氮[22, 80],则需要对植物进行遗传改造使其能够释放结瘤信号,但由于固氮酶生物合成的复杂性以及其对于氧气的敏感性,将编码固氮酶的nif基因导入非豆科植物仍面临很大的困难。共生固氮需要30多个必需基因的协同作用[23],如何保证这些基因能够同时在细胞中进行表达需要更加深入的研究。如果考虑直接将固氮酶导入禾谷类植物细胞中[140−141],固氮酶生物合成的复杂性以及酶对氧气的敏感性也是需要面临的问题,而且目前还不清楚禾谷类作物宿主能否提供维持固氮酶催化所需的能量[142]。另外,也有研究者提出真核生物的线粒体、叶绿体这两种细胞器可以提供一个低氧的环境[143−146],有利于克服固氮酶的氧敏感性,促进其发挥功能,除此之外,这两种细胞器可以提供大量的ATP以及固氮酶活性表达所需的还原物质[80],在基因组织和表达方面也与原核生物类似,因此可以作为固氮酶基因表达的重要载体。最近的研究发现,nifH基因成功导入烟草的叶绿体中并实现了蛋白质表达[143−144];Azotobacter vinelandii的9个nif基因(nifH、nifD、nifK、nifU、nifS、nifM、nifB、nifE、nifN)也成功在酵母线粒体中表达[143]。2023年《Science》发文揭示了大麦中LysM受体本身不能形成共生固氮根瘤,但可以激活豆科植物根瘤器官形成,这可以使生物固氮进入谷类植物[125]。2024年《PNAS》(Proceedings of the National Academy of Sciences of the United States of America)刊物报道了4个重要的磷酸化位点是共生固氮的催化因子,也是将共生固氮转移到非豆科植物的重要一步[126]。
虽然共生固氮仅限于豆科植物,但豆科植物共生信号(SYM)途径的几个组分也在丛枝菌根共生中发挥作用,许多植物,包括禾谷类植物,能够形成丛枝菌根联合体,但是缺乏形成固定氮素根瘤的能力。由于禾谷类作物中含有丛枝菌根结合的SYM途径,因此这种结合可以被设计来感知根瘤信号分子进而激活该途径,并通过其激活产生的信号促进根瘤状根器官中进行固氮[22]。最近的研究也表明,一小部分基因可以将与丛枝菌根真菌相关的物种转化为固氮共生体[138, 142]。禾谷类作物可与丛枝菌根共生,该共生与根瘤共生具有共同的共生信号途径,为合成生物学将豆科植物根瘤共生的特异性基因导入非豆科植物中提供了可能性[22]。通过基因工程等技术将生物固氮引入禾谷类作物中仍面临很多挑战,目前主要有两种策略,一是通过将豆科植物根瘤共生发育所必需的基因转移到禾谷类作物中,构建禾谷类与固氮菌之间的新型共生体[5, 8, 147];二是直接将固氮酶导入禾谷类植物细胞中[5, 8, 140−141]。但固氮过程涉及一系列复杂的基因调控,固氮酶的氧失活、固氮基因表达的铵抑制及固氮反应的高耗能3个关键限制因素也需要相应的解决方法[92, 127, 142]。创造适合固氮基因表达的环境,并采用适当的方式将共生固氮机制引入禾谷类作物中,建立禾谷类作物固氮新体系,开发“氮肥自供型”作物,对实现粮食作物共生固氮、减少工业氮肥施用、发展农业新质生产力具有重要意义。
生物固氮是作物生产中环境友好型氮源,优化生物固氮对于维持粮食生产和环境安全至关重要。高效的固氮菌株已被用于生物肥料的生产,特别是用于氮肥投入量少的贫瘠土壤[148]。鉴定具有高效固氮能力的菌株并将其投入农业生产中,对于提高氮利用至关重要,其对农业产生积极影响,也打开了生物肥料市场。生物肥料可以显著减少化学氮肥的施用[49−58, 149],同时在改善作物生长、提高产量[29, 150]及抗逆性[30, 67−69]等方面表现出巨大的潜力。除了传统的单菌株分离物,开发具有多种功能的细菌合成菌群[130, 151],可以更好地促进植物生产。共接种联合固氮菌(Paenibacillus beijingensis BJ-18)和溶磷菌(Paenibacillus sp. B1)显著提高了植株的生物量和固氮酶活性[152]。在实际应用过程中,对选择的菌株基因组进行有针对性修饰,可以使其更好的发挥优势[153]。接种联合固氮菌固氮螺菌(Azospirillum sp.)有助于提高和稳定作物产量,但其具体作用效果与作物管理措施、环境条件等密切相关[47]。因此,在商业化之前要测试不同环境条件和土壤类型下菌株的固氮效能,亦可通过基因工程等技术改造固氮菌株以增强其抗逆性及固氮效率,研发新型功能生物肥料[154],确保最终接种菌的固氮效率、促生效果的稳定性和持久性,满足不同的农业需求。此外,传统的固氮菌肥田间应用效果不稳定,尚需要不断优化固氮包膜、种子包衣、滴灌施肥等技术,提高固氮菌肥的利用效率。如在配方工艺中也可以采用固氮菌中的基因工程来提高包囊能力[25],生产出具有较长时间保质期、抗污染和恶劣环境条件的包囊。利用现有技术进一步挖掘新型高效固氮微生物资源,或通过基因工程、合成生物学等技术改造以获得固氮效率更高、更稳定的菌株,开发具有创新和竞争力的固氮菌基生物肥料并优化菌肥应用技术,转变氮肥工业格局,助力实现绿色低碳农业生产。
5. 结论
基于1990—2023年生物固氮研究领域的中英文文献分析发现,1990年至今生物固氮研究领域的发文量逐渐增加,近10年增长速率加快,且中国发文量所占比例也逐年增加。美国、中国、巴西、德国等国家在该领域发文较多,相互之间合作密切,中国目前已成为该领域发文数量第2的国家;主要发文期刊有《Plant and Soil》、《Soil Biology & Biochemistry》、《生物技术通报》等;国际上各机构间交流合作密切,中国科学院大学、中国农业大学、中国农业科学院与哥本哈根大学、瑞典农业科学大学、约翰英纳斯中心等机构合作较为密切。生物固氮研究的关键词共现网络可分为4个聚类:生物固氮相关微生物及其定殖,生物固氮对农业生产的影响,生物固氮的分子机理,以及生物固氮的影响因素。
随着技术的发展,多学科的交叉以及新兴技术的应用,生物固氮已逐渐从其表现研究深入到机理研究,并取得了一系列进展。今后的研究要聚焦于当聚焦于以下几个方面:一是如何扩大根瘤菌的宿主范围,提高根际联合固氮的效率;二是运用新兴技术和方法,将生物固氮机制引入禾谷类作物中,致力于开发出“氮肥自供型”作物;三是不断挖掘高效固氮微生物资源,并优化菌肥的应用技术。同时,更要坚持科技创新,通过前沿技术的发展更深入探究生物固氮的机理,并将其应用于农业生产,发展新质生产力,促进我国农业的发展。
-
图 1 1990—2023年中英文期刊有关生物固氮的发文量(a)、中国研究对英文文献的贡献率(b)及WOS (c)和CNKI (d)数据库生物固氮相关研究发文量排在前10名的学科
Figure 1. The number of literature on biological nitrogen fixation in Chinese and English from 1990 to 2023 (a), the contribution of Chinese researches to the English literature (b) , and the top 10 disciplines involved in biological nitrogen fixation researches based on data from WOS (c) and CNKI (d) databases from 1990 to 2023
图 2 生物固氮英文和中文文献的产出国家或者主要机构间相关合作关系网络
注:(a)图为英文文献主要产出国家之间的联系,(b)图为英文文献主要产出机构间的联系,(c)中文文献主要产出机构间的联系。其中(a)、(b)图中圆圈的大小代表发文量的多少,曲线的粗细代表合作强度的强弱。
Figure 2. Collaborative networks among the contributor countries or major institutions that published biological nitrogen fixation papers in English or Chinese
Note: Figure (a), the network between countries contributing papers in English. Figure (b), the network between institutions contributing papers in English. Figure(c), the network between institutions contributing papers in Chinese. In figures (a) and (b), the size of the circle represents the number of papers, and the thickness of the curve represents the strength of the collaboration.
表 1 1990—2023年生物固氮研究发文量前5的期刊
Table 1 Top 5 English and Chinese journals for biological nitrogen fixation research during 1990−2023
期刊名称
Journal发文量
Number of paper2023年影响因子
Impact factor in 2023本地引用
Local reference (TLCS)总引用
Total reference (TGCS)Plant and Soil 333 3.9 4230 20236 Soil Biology & Biochemistry 195 9.8 1515 8640 Frontiers in Microbiology 179 4.0 906 6033 PLoS ONE 119 2.9 752 4480 Frontiers in Plant Science 118 4.1 990 5113 《生物技术通报》 Biotechnology Bulletin 53 1.335 51 372 《植物营养与肥料学报》
Journal of Plant Nutrition and Fertilizers27 3.282 143 1283 《大豆科学》 Soybean Science 27 1.314 48 600 《华中农业大学学报》
Journal of Huazhong Agricultural University26 1.767 27 225 《中国农业科学》 Scientia Agricultura Sinica 24 2.613 181 1498 表 2 WOS和CNKI数据库中1990—2023年生物固氮研究领域发文量排名前5的学者
Table 2 Top 5 authors in number of papers published addressing biological nitrogen fixation in WOS and CNKI databases during 1990−2023
作者
Author发文量
Number
of paper机构
Institution主要研究方向
Main research direction本地引用
Local
reference
(TLCS)总引用
Total
reference
(TGCS)Hungria M 132 巴西农业研究公司
Brazilian Agricultural Research
Corporation (Embrapa)植物生长促生菌接种对作物和土壤的影响
Effect of plant growth-promoting bacteria inoculation
on crops and soil1181 5452 Urquiaga S 65 施肥对生物固氮及其它营养元素的影响
Effect of fertilization on biological nitrogen fixation
and other nutrient elements1220 3862 Boddey R M 64 生物固氮对作物生产的影响 (N2丰度)
Effect of biological nitrogen fixation on crop production
(N2 abundance)1690 5178 Zehr J P 62 加州大学圣克鲁兹分校
University of California, Santa Cruz海洋固氮微生物群落
Marine nitrogen-fixing microbial communities1265 5601 Woyke T 55 劳伦斯伯克利国家实验室
Lawrence Berkeley National Laboratory生物固氮机理 (基因层面)
Biological nitrogen fixation mechanism (gene level)70 1225 李友国
Li Youguo51 华中农业大学
Huazhong Agricultural University根瘤菌共生固氮的分子机理及应用
Molecular mechanism and application of rhizobium
symbiotic nitrogen fixation27 183 李杨瑞
Li Yangrui33 中国农业科学院
Chinese Academy of
Agricultural Sciences甘蔗生物固氮
Biological nitrogen fixation in sugarcane63 697 燕永亮
Yan Yongliang22 固氮微生物基因组学、分子生物学等
Genomics and molecular biology of nitrogen-fixing
microorganisms, etc.33 212 杨丽涛
Yang Litao20 广西大学
Guangxi University甘蔗生物固氮
Biological nitrogen fixation in sugarcane35 388 王卫卫
Wang Weiwei19 西北大学
Northwest University共生固氮生态生理学及根际微生物多样性
Ecophysiology of symbiotic nitrogen fixation and
rhizosphere microbial diversity11 243 表 3 高被引文献基本信息
Table 3 Basic information of highly cited papers
标题
Title第一作者
The first author发文期刊及年份
Journal and year of publication本地引用
Local
reference
(TLCS)总引用
Total
reference
(TGCS)Global inputs of biological nitrogen fixation in agricultural systems Herridge D F Plant and Soil,2008 342 995 Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems Cleveland C C Global Biogeochemical Cycles,
1999233 691 Genetic regulation of biological nitrogen fixation Dixon R Nature Review Microbiology,2004 217 728 Nitrogen cycles: past, present, and future Galloway J N Biogeochemistry,2004 212 3735 Nitrogenase gene diversity and microbial community structure: a cross-system comparison Zehr J P Environment Microbiology,2003 208 710 中国氮肥发展、贡献和挑战
The development and contribution of nitrogenous fertilizer in China
and challenges faced by the country张卫峰
Zhang Weifeng中国农业科学
Scientia Agricultura Sinica 201349 490 土壤微生物在促进植物生长方面的作用
Effect of soil microbes on plant growth吴建峰
Wu Jianfeng土壤 Soils,2003 25 488 土壤氮素转化的关键微生物过程及机制
Key processes and microbial mechanisms of soil nitrogen transformation贺纪正
He Jizheng微生物学通报
Microbiology China,201349 489 间套作强化农田生态系统服务功能的研究进展与应用展望
Intercropping enhances agroecosystem services and function: Current
knowledge and perspectives李隆
Li Long中国生态农业学报 Chinese Journal of Eco-Agriculture,2016 47 327 中国生物固氮研究现状和展望
Research status and prospect of biological nitrogen fixation in China沈世华
Shen Shihua科学通报
Chinese Science Bulletin,200316 309 -
[1] Ray D, Daniel K. Genetic regulation of biological nitrogen fixation[J]. Nature Reviews Microbiology, 2004, 2(8): 621−631. DOI: 10.1038/nrmicro954
[2] Masson-Boivin C, Sachs L J. Symbiotic nitrogen fixation by rhizobia−the roots of a success story[J]. Current Opinion in Plant Biology, 2018, 44: 7−15. DOI: 10.1016/j.pbi.2017.12.001
[3] Graham P H. Stress tolerance in Rhizobium and Bradyrhizobium, and nodulation under adverse soil conditions[J]. Canadian Journal of Microbiology, 1992, 38(6): 475−484. DOI: 10.1139/m92-079
[4] Peoples M B, Brockwell J, Herridge D F. The contributions of nitrogen-fixing crop legumes to the productivity of agricultural systems[J]. Symbiosis, 2009, 48(1/3): 1−17.
[5] Soumare A, Diedhiou A G, Thuita M, et al. Exploiting biological nitrogen fixation: A route towards a sustainable agriculture[J]. Plants, 2020, 9(8): 1011. DOI: 10.3390/plants9081011
[6] Wang Y Y, Wang X L, Sun S, et al. GWAS, MWAS and mGWAS provide insights into precision agriculture based on genotype-dependent microbial effects in foxtail millet[J]. Nature Communications, 2022, 13(1): 5913. DOI: 10.1038/s41467-022-33238-4
[7] Wang D P, Dong W T, Murray J, Wang E T. Innovation and appropriation in mycorrhizal and rhizobial symbioses[J]. Plant Cell, 2022, 34(5): 1573−1599. DOI: 10.1093/plcell/koac039
[8] Guo K Y, Yang J, Yu N, et al. Biological nitrogen fixation in cereal crops: Progress, strategies, and perspectives[J]. Plant Communications, 2022, 4(2): 100499.
[9] Roy S, Liu W, Nandety R S, et al. Celebrating 20 years of genetic discoveries in legume nodulation and symbiotic nitrogen fixation[J]. Plant Cell, 2020, 32(1): 15−41. DOI: 10.1105/tpc.19.00279
[10] Yang J, Lan L Y, Jin Y, et al. Mechanisms underlying legume-rhizobium symbioses[J]. Journal of Integrative Plant Biology, 2022, 64(2): 244−267. DOI: 10.1111/jipb.13207
[11] Markmann K, Parniske M. Evolution of root endosymbiosis with bacteria: How novel are nodules?[J]. Trends in Plant Science, 2008, 14(2): 77−86.
[12] Kistner C, Parniske M. Evolution of signal transduction in intracellular symbiosis[J]. Trends in Plant Science, 2002, 7(11): 511−518. DOI: 10.1016/S1360-1385(02)02356-7
[13] Pueppke S G, Broughton W J. Rhizobium sp. strain NGR234 and R-fredii USDA257 share exceptionally broad, nested host ranges[J]. Molecular Plant-Microbe Interactions, 1999, 12(4): 293−318. DOI: 10.1094/MPMI.1999.12.4.293
[14] Imran A, Hakim S, Tariq M, et al. Diazotrophs for lowering nitrogen pollution crises: Looking deep into the roots[J]. Frontiers in Microbiology, 2021, 12: 637815. DOI: 10.3389/fmicb.2021.637815
[15] Cleveland C C, Townsend A R, Schimel D S, et al. Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems[J]. Global Biogeochemical Cycles, 1999, 13(2): 623−645. DOI: 10.1029/1999GB900014
[16] Diagne N, Arumugam K, Ngom M, et al. Use of Frankia and actinorhizal plants for degraded lands reclamation[J]. BioMed Research International, 2013, 201(1): 948258.
[17] 张丽梅. 高效联合固氮菌的筛选、鉴定及其生理生化特征和接种效应研究[D]. 浙江杭州: 浙江大学硕士学位论文, 2002. Zhang L M. Selection and identification of an associative nitrogen-fixing bacterium strain with high efficiency and investigation of its physiological characteristics and of its inoculation effects[D]. Hangzhou, Zhejiang: MS Thesis of Zhejiang University, 2002.
[18] Montañez A, Blanco A R, Barlocco C, et al. Characterization of cultivable putative endophytic plant growth promoting bacteria associated with maize cultivars (Zea mays L.) and their inoculation effects in vitro[J]. Applied Soil Ecology, 2012, 58: 21−28. DOI: 10.1016/j.apsoil.2012.02.009
[19] Oliveira A D, Urquiaga S, Döbereiner J, Baldani J I. The effect of inoculating endophytic N2-fixing bacteria on micropropagated sugarcane plants[J]. Plant and Soil, 2002, 242(2): 205−215. DOI: 10.1023/A:1016249704336
[20] 燕永亮, 田长富, 杨建国, 等. 人工高效生物固氮体系创建及其农业应用[J]. 生命科学, 2021, 33(12): 1532−1543. Yan Y L, Tian C F, Yang J G, et al. Establishment of artificial efficiency biological nitrogen fixation system and its agricultural application[J]. Chinese Bulletin of Life Science, 2021, 33(12): 1532−1543.
[21] Good A. Toward nitrogen-fixing plants[J]. Science, 2018, 359: 869−870. DOI: 10.1126/science.aas8737
[22] Mus F, Crook M B, Garcia K, et al. Symbiotic nitrogen fixation and the challenges to its extension to nonlegumes[J]. Applied and Environmental Microbiology, 2016, 82(13): 3698−3710. DOI: 10.1128/AEM.01055-16
[23] Roger C, Oldroyd G E D. Synthetic biology approaches to engineering the nitrogen symbiosis in cereals[J]. Journal of Experimental Botany, 2014, 65(8): 1939−1946. DOI: 10.1093/jxb/eru098
[24] 沈世华, 荆玉祥. 中国生物固氮研究现状和展望[J]. 科学通报, 2003, 48(6): 535−540. DOI: 10.3321/j.issn:0023-074X.2003.06.003 Shen S H, Jing Y X. Research status and prospect of biological nitrogen fixation in China[J]. Chinese Science Bulletin, 2003, 48(6): 535−540. DOI: 10.3321/j.issn:0023-074X.2003.06.003
[25] Aasfer A, Bargaz A, Yaakoubi K, et al. Nitrogen fixing Azotobacter species as potential soil biological enhancers for crop nutrition and yield stability[J]. Frontiers in Microbiology, 2021, 12: 628379. DOI: 10.3389/fmicb.2021.628379
[26] Etesami H, Maheshwari D K. Use of plant growth promoting rhizobacteria (PGPRs) with multiple plant growth promoting traits in stress agriculture: Action mechanisms and future prospects[J]. Ecotoxicology and Environmental Safety, 2018, 156: 225−246. DOI: 10.1016/j.ecoenv.2018.03.013
[27] Oleńska E, Małek W, Wójcik M, et al. Beneficial features of plant growth-promoting rhizobacteria for improving plant growth and health in challenging conditions: A methodical review[J]. Science of the Total Environment, 2020, 743: 140682. DOI: 10.1016/j.scitotenv.2020.140682
[28] 周益帆, 白寅霜, 岳童, 等. 植物根际促生菌促生特性研究进展[J]. 微生物学通报, 2023, 50(2): 644−666. Zhou Y F, Bai Y S, Yue T, et al. Research progress on the growth-promoting characteristics of plant growth-promoting rhizobacteria[J]. Microbiology China, 2023, 50(2): 644−666.
[29] Subramaniam G, Vadlamudi S, Srinivasan S. Nitrogen fixation, plant growth and yield enhancements by diazotrophic growth-promoting bacteria in two cultivars of chickpea (Cicer arietinum L.)[J]. Biocatalysis and Agricultural Biotechnology, 2017, 11: 116−123. DOI: 10.1016/j.bcab.2017.06.012
[30] Ruzzi M, Aroca R. Plant growth-promoting rhizobacteria act as biostimulants in horticulture[J]. Scientia Horticulturae, 2015, 196: 124−134. DOI: 10.1016/j.scienta.2015.08.042
[31] Khan N, Ali S, Shahid M A, et al. Insights into the interactions among roots, rhizosphere, and rhizobacteria for improving plant growth and tolerance to abiotic stresses: A review[J]. Cells, 2021, 10(6): 1551. DOI: 10.3390/cells10061551
[32] Dixon R A, Postgate J R. Genetic transfer of nitrogen fixation from Klebsiella-pneumoniae to Escherichia-coil[J]. Nature, 1972, 237: 102. DOI: 10.1038/237102a0
[33] 陈中义, 林敏. 首例属间遗传工程微生物进入商品化生产[J]. 生物技术通报, 1998, (6): 42−43. Chen Z Y, Lin M. The first intergeneric genetically engineered microorganism entered commercial production[J]. Biotechnology Bulletin, 1998, (6): 42−43.
[34] Galibert F, Finan T M, Long S R, et al. The composite genome of the legume symbiont Sinorhizobium meliloti[J]. Science, 2001, 293: 668−672. DOI: 10.1126/science.1060966
[35] van Eck N J, Waltman L. Software survey: VOSviewer, a computer program for bibliometric mapping[J]. Scientometrics, 2010, 84(2): 523−538. DOI: 10.1007/s11192-009-0146-3
[36] Garfield E. From the science of science to scientometrics visualizing the history of science with HistCite software[J]. Journal of Informetrics, 2009, 3(3): 173−179.
[37] 严康, 汪海珍, 楼骏, 徐建明. 基于Web of Science对土传病害研究现状和趋势的计量分析[J]. 土壤学报, 2020, 57(3): 680−690. Yan K, Wang H Z, Lou J, Xu J M. Bibliometric analysis of status quo and trend of the research on soil-borne diseases based on the Web of Science database[J]. Acta Pedologica Sinica, 2020, 57(3): 680−690.
[38] 吴建峰, 林先贵. 土壤微生物在促进植物生长方面的作用[J]. 土壤, 2003, 35(1): 18−21. Wu J F, Lin X G. Effects of soil microbes on plant growth[J]. Soils, 2003, 35(1): 18−21.
[39] 王加龙, 刘驰, 雷丽, 等. 非共生固氮菌及其固氮作用[J]. 微生物学报, 2022, 62(8): 2861−2878. Wang J L, Liu C, Lei L, et al. Asymbiotic nitrogen-fixing bacteria and their nitrogen fixation potential[J]. Acta Microbiologica Sinica, 2022, 62(8): 2861−2878.
[40] Zehr J P, Jenkins B D, Short S M, Steward G F. Nitrogenase gene diversity and microbial community structure: A cross-system comparison[J]. Environmental Microbiology, 2003, 5(7): 539−554. DOI: 10.1046/j.1462-2920.2003.00451.x
[41] 勾宇春, 王宗抗, 张志鹏, 等. 植物根际促生菌作用机制研究进展[J]. 应用与环境生物学报, 2023, 29(2): 495−506. Gou Y C, Wang Z K, Zhang Z P, et al. Advance in role mechanisms of plant growth-promoting rhizobacteria[J]. Chinese Journal of Applied and Environmental Biology, 2023, 29(2): 495−506.
[42] Sun X L, Xu Z H, Xie J Y, et al. Bacillus velezensis stimulates resident rhizosphere Pseudomonas stutzeri for plant health through metabolic interactions [J]. The ISME Journal, 2021, 16(3): 774−787.
[43] de Novais C B, Sbrana C, Jesus E C, et al. Mycorrhizal networks facilitate the colonization of legume roots by a symbiotic nitrogen-fixing bacterium[J]. Mycorrhiza, 2020, 30(2/3): 389−396.
[44] Parniske M. Arbuscular mycorrhiza: The mother of plant root endosymbiosis[J]. Nature Reviews Microbiology, 2008, 6(10): 763−775. DOI: 10.1038/nrmicro1987
[45] Dellagi A, Quillere I, Hirel B. Beneficial soil-borne bacteria and fungi: A promising way to improve plant nitrogen acquisition[J]. Journal of Experimental Botany, 2020, 71(15): 4469−4479. DOI: 10.1093/jxb/eraa112
[46] Yoneyama T, Terakado-Tonooka J, Bao Z H, Minamisawa K. Molecular analyses of the distribution and function of diazotrophic rhizobia and methanotrophs in the tissues and rhizosphere of non-leguminous plants[J]. Plants, 2019, 8(10): 408. DOI: 10.3390/plants8100408
[47] Cassán F, Coniglio A, López G, et al. Everything you must know about Azospirillum and its impact on agriculture and beyond[J]. Biology and Fertility of Soils, 2020, 56(4): 461−479. DOI: 10.1007/s00374-020-01463-y
[48] 徐鹏霞, 韩丽丽, 贺纪正, 等. 非共生生物固氮微生物分子生态学研究进展[J]. 应用生态学报, 2017, 28(10): 3440−3450. Xu P X, Han L L, He J Z, et al. Research advance on molecular ecology of asymbiotic nitrogen fixation microbes[J]. Chinese Journal of Applied Ecology, 2017, 28(10): 3440−3450.
[49] Kifle M H, Laing M D. Effects of selected diazotrophs on maize growth[J]. Frontiers in Plant Science, 2016, 7: 1429.
[50] 靳海洋, 王慧, 张燕辉, 等. 基于基因组的一株土壤固氮菌分离菌株鉴定及其促生作用[J]. 微生物学报, 2021, 61(10): 3249−3263. Jin H Y, Wang H, Zhang Y H, et al. Genome-based identification and plant growth promotion of a nitrogen-fixing strain isolated from soil[J]. Acta Microbiogica Sinica, 2021, 61(10): 3249−3263.
[51] 贺纪正, 张丽梅. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 2013, 40(1): 98−108. He J Z, Zhang L M. Key processes and microbial mechanisms of soil nitrogen transformation[J]. Microbiology China, 2013, 40(1): 98−108.
[52] Herridge D F, Peoples M B, Boddey R M. Global inputs of biological nitrogen fixation in agricultural systems[J]. Plant and Soil, 2008, 311(1/2): 1−18.
[53] 张卫峰, 马林, 黄高强, 等. 中国氮肥发展、贡献和挑战[J]. 中国农业科学, 2013, 46(15): 3161−3171. Zhang W F, Ma L, Huang G Q, et al. The development and contribution of nitrogenous fertilizer in China and challenges faced by the country[J]. Scientia Agricultura Sinica, 2013, 46(15): 3161−3171.
[54] West C P, Gerber S J, Engstrom M P, et al. Leverage points for improving global food security and the environment[J]. Science, 2014, 345: 325−328. DOI: 10.1126/science.1246067
[55] Dasgupta D, Paul A, Acharya K, et al. Bioinoculant mediated regulation of signalling cascades in various stress responses in plants[J]. Heliyon, 2023, 9(1): e12953. DOI: 10.1016/j.heliyon.2023.e12953
[56] Zapata F, Danso S K A, Hardarson G, Fried M. Time course of nitrogen fixation in field-grown soybean using nitrogen-15 methodology[J]. Agronomy Journal, 1987, 79(1): 172−176. DOI: 10.2134/agronj1987.00021962007900010035x
[57] Yeoh Y K, Paungfoo-Lonhienne C, Dennis P G, et al. The core root microbiome of sugarcanes cultivated under varying nitrogen fertilizer application[J]. Environmental Microbiology, 2016, 18(5): 1338−1351. DOI: 10.1111/1462-2920.12925
[58] Banik A, Dash G K, Swain P, et al. Application of rice ( Oryza sativa L.) root endophytic diazotrophic Azotobacter sp. strain Avi2 (MCC 3432) can increase rice yield under green house and field condition[J]. Microbiological Research, 2018, 219: 56−65.
[59] Sashidhar B, Podile A R. Transgenic expression of glucose dehydrogenase in Azotobacter vinelandii enhances mineral phosphate solubilization and growth of sorghum seedlings[J]. Microbial Biotechnology, 2009, 2(4): 521−529. DOI: 10.1111/j.1751-7915.2009.00119.x
[60] Yi Y M, Huang W Y, Ge Y. Exopolysaccharide: A novel important factor in the microbial dissolution of tricalcium phosphate[J]. World Journal of Microbiology and Biotechnology, 2008, 24(7): 1059−1065. DOI: 10.1007/s11274-007-9575-4
[61] Datta C, Basu P. Indole acetic acid production by a Rhizobium species from root nodules of a leguminous shrub, Cajanus cajan[J]. Microbiological Research, 2000, 155(2): 123−127. DOI: 10.1016/S0944-5013(00)80047-6
[62] Ghosh S, Basu P S. Production and metabolism of indole acetic acid in roots and root nodules of Phaseolus mungo[J]. Microbiological Research, 2006, 161(4): 362−366. DOI: 10.1016/j.micres.2006.01.001
[63] Liu H, Zhang C, Yang J, et al. Hormone modulation of legume-rhizobial symbiosis[J]. Journal of Integrative Plant Biology, 2018, 60(8): 632−648. DOI: 10.1111/jipb.12653
[64] Bhattacharyya P N, Jha D K. Plant growth-promoting rhizobacteria (PGPR): Emergence in agriculture[J]. World Journal of Microbiology & Biotechnology, 2012, 28(4): 1327−1350.
[65] Yang J, Kloepper J W, Ryu C M. Rhizosphere bacteria help plants tolerate abiotic stress[J]. Trends in Plant Science, 2009, 14(1): 1−4. DOI: 10.1016/j.tplants.2008.10.004
[66] Ke X L, Xiao H, Peng Y Q, et al. Phosphoenolpyruvate reallocation links nitrogen fixation rates to root nodule energy state[J]. Science, 2022, 378: 971−977. DOI: 10.1126/science.abq8591
[67] Chaudhary D, Narula N, Sindhu S S, et al. Plant growth stimulation of wheat (Triticum aestivum L.) by inoculation of salinity tolerant Azotobacter strains[J]. Physiology and Molecular Biology of Plants, 2013, 1 9(4): 515−519.
[68] Rojas-Tapias D, Moreno-Galván A, Pardo-Díaz S, et al. Effect of inoculation with plant growth-promoting bacteria (PGPB) on amelioration of saline stress in maize (Zea mays)[J]. Applied Soil Ecology, 2012, 61: 264−272. DOI: 10.1016/j.apsoil.2012.01.006
[69] Latef A A H A, Alhmad A M F, Kordrostami M, et al. Inoculation with Azospirillum lipoferum or Azotobacter chroococcum reinforces maize growth by improving physiological activities under saline conditions[J]. Journal of Plant Growth Regulation, 2020, 39(3): 1293−1306. DOI: 10.1007/s00344-020-10065-9
[70] Plett J M, Martin F M. Know your enemy, embrace your friend: Using omics to understand how plants respond differently to pathogenic and mutualistic microorganisms[J]. The Plant Journal, 2018, 93(4): 729−746. DOI: 10.1111/tpj.13802
[71] Bakker A P, Berendsen R L, Doornbos R F, et al. The rhizosphere revisited: Root microbiomics[J]. Frontiers in Plant Science, 2013, 4: 165.
[72] Keswani C, Singh H B, Garcia-Estrada C, et al. Antimicrobial secondary metabolites from agriculturally important bacteria as next-generation pesticides[J]. Applied Microbiology and Biotechnology, 2020, 104(3): 1013−1034. DOI: 10.1007/s00253-019-10300-8
[73] Joshi P M, Juwarkar A A. In vivo studies to elucidate the role of extracellular polymeric substances from Azotobacter in immobilization of heavy metals[J]. Environmental Science & Technology, 2009, 43(15): 5884−5889.
[74] Vacheron J, Desbrosses G, Bouffaud M, et al. Plant growth-promoting rhizobacteria and root system functioning[J]. Frontiers in Plant Science, 2013, 4: 356.
[75] Eastman A W, Heinrichs D E, Yuan Z C. Comparative and genetic analysis of the four sequenced Paenibacillus polymyxa genomes reveals a diverse metabolism and conservation of genes relevant to plant-growth promotion and competitiveness[J]. BMC Genomics, 2014, 15(1): 851. DOI: 10.1186/1471-2164-15-851
[76] Ohki Y, Munakata K, Matsuoka Y, et al. Nitrogen reduction by the Fe sites of synthetic [Mo3S4Fe] cubes[J]. Nature, 2022, 607: 86−90. DOI: 10.1038/s41586-022-04848-1
[77] Dos Santos P C, Fang Z, Mason S W, et al. Distribution of nitrogen fixation and nitrogenase-like sequences amongst microbial genomes[J]. BMC Genomics, 2012, 13(1): 162. DOI: 10.1186/1471-2164-13-162
[78] McGlynn S E, Boyd E S, Peters J W, Orphan V J. Classifying the metal dependence of uncharacterized nitrogenases[J]. Frontiers in Microbiology, 2013, 3: 419.
[79] Nonaka A, Yamamoto H, Kamiya N, et al. Accessory proteins of the nitrogenase assembly, nifW, nifX / nafY, and nifZ, are essential for diazotrophic growth in the nonheterocystous cyanobacterium Leptolyngbya boryana[J]. Frontiers in Microbiology, 2019, 10: 495. DOI: 10.3389/fmicb.2019.00495
[80] Buren S, Rubio L M. State of the art in eukaryotic nitrogenase engineering[J]. FEMS Microbiology Letters, 2018, 365(2): 274.
[81] Lee S, Reth A, Meletzus D, et al. Characterization of a major cluster of nif, fix, and associated genes in a sugarcane endophyte, Acetobacter diazotrophicus[J]. Journal of Bacteriology, 2000, 182(24): 7088−7091. DOI: 10.1128/JB.182.24.7088-7091.2000
[82] Wurzburger N, Hedin L O. Taxonomic identity determines N2 fixation by canopy trees across lowland tropical forests[J]. Ecology Letters, 2016, 19(1): 62−70. DOI: 10.1111/ele.12543
[83] Jean M E, Phalyvong K, Forest-Drolet J, Bellenger J P. Molybdenum and phosphorus limitation of asymbiotic nitrogen fixation in forests of Eastern Canada: Influence of vegetative cover and seasonal variability[J]. Soil Biology and Biochemistry, 2013, 67: 140−146. DOI: 10.1016/j.soilbio.2013.08.018
[84] Fay P. Oxygen relations of nitrogen-fixation in cyanobacteria[J]. Microbiological Reviews, 1992, 56(2): 340−373. DOI: 10.1128/mr.56.2.340-373.1992
[85] Ribbe M, Gadkari D, Meyer O. N2 fixation by Streptomyces thermoautotrophicus involves a molybdenum-dinitrogenase and a manganese-superoxide oxidoreductase that couple N2 reduction to the oxidation of superoxide produced from O2 by a molybdenum-CO dehydrogenase[J]. Journal of Biological Chemistry, 1997, 272(42): 26627−26633. DOI: 10.1074/jbc.272.42.26627
[86] Oldroyd G E D. Speak, friend, and enter: Signalling systems that promote beneficial symbiotic associations in plants[J]. Nature Reviews Microbiology, 2013, 11(4): 252−263. DOI: 10.1038/nrmicro2990
[87] Zhang W, Luo X, Mei Y Z, et al. Priming of rhizobial nodulation signaling in the mycosphere accelerates nodulation of legume hosts[J]. New Phytologist, 2022, 235(3): 1212−1230. DOI: 10.1111/nph.18192
[88] Zhang B, Wang M D, Sun Y F, et al. Glycine maxNNL1 restricts symbiotic compatibility with widely distributed bradyrhizobia via root hair infection [J]. Nature Plants, 2021, 7(1): 73−86.
[89] Timmers A C J, Auriac M C, Truchet G. Refined analysis of early symbiotic steps of the Rhizobium-Medicago interaction in relationship with microtubular cytoskeleton rearrangements[J]. Development, 1998, 126(16): 3617−3628.
[90] Mortier V, Holsters M, Goormachtigc S. Never too many? How legumes control nodule numbers[J]. Plant Cell and Environment, 2012, 35(2): 245−258. DOI: 10.1111/j.1365-3040.2011.02406.x
[91] Dong W T, Zhu Y Y, Chang H Z, et al. An SHR–SCR module specifies legume cortical cell fate to enable nodulation[J]. Nature, 2020, 589: 586−590.
[92] Jiang S Y, Jardinaud M F, Gao J P, et al. NIN-like protein transcription factors regulate leghemoglobin genes in legume nodules[J]. Science, 2021, 374: 625−628. DOI: 10.1126/science.abg5945
[93] Wang T, Guo J, Peng Y Q, et al. Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation[J]. Science, 2021, 374: 65−71. DOI: 10.1126/science.abh2890
[94] Chi F, Shen S H, Cheng H P, et al. Ascending migration of endophytic rhizobia, from roots to leaves, inside rice plants and assessment of benefits to rice growth physiology[J]. Applied and Environmental Microbiology, 2005, 7(11): 7271−7278.
[95] Thaweenut N, Hachisuka Y, Ando S, et al. Two seasons’ study on nifH gene expression and nitrogen fixation by diazotrophic endophytes in sugarcane (Saccharum spp. hybrids): Expression of nifH genes similar to those of rhizobia[J]. Plant and Soil, 2011, 338(1/2): 435−449.
[96] Dreyfus B L, Elmerich C, Dommergues Y R. Free-living Rhizobium strain able to grow on N2 as the soil nitrogen-source[J]. Applied and Environmental Microbiology, 1983, 45(2): 711−713. DOI: 10.1128/aem.45.2.711-713.1983
[97] Wang Q, Huang Y G, Ren Z J, et al. Transfer cells mediate nitrate uptake to control root nodule symbiosis[J]. Nature Plants, 2020, 6(7): 800−808. DOI: 10.1038/s41477-020-0683-6
[98] 郭佩, 王佳艺, 史晓龙, 等. 施氮量对不同基因型花生结瘤特性及氮素利用的影响[J]. 沈阳农业大学学报, 2022, 53(4): 385−393. DOI: 10.3969/j.issn.1000-1700.2022.04.001 Guo P, Wang J Y, Shi X L, et al. Effects of nitrogen application rate on nodule characteristics and nitrogen utilization in different peanut genotypes[J]. Journal of Shenyang Agricultural University, 2022, 53(4): 385−393. DOI: 10.3969/j.issn.1000-1700.2022.04.001
[99] Barbulova A, Rogato A, D`Apuzzo E, et al. Differential effects of combined N sources on early steps of the nod factor-dependent transduction pathway in Lotus japonicus[J]. Molecular Plant-Microbe Interactions, 2007, 20(8): 994−1003. DOI: 10.1094/MPMI-20-8-0994
[100] 郑永美, 王春晓, 刘岐茂, 等. 氮肥对花生根系生长和结瘤能力的调控效应[J]. 核农学报, 2017, 31(12): 2418−2425. Zheng Y M, Wang C X, Liu Q M, et al. Effect of nitrogen fertilizer regulation on root growth and nodulating ability of peanut[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(12): 2418−2425.
[101] 陈敏. 根瘤菌NodD蛋白与植物类黄酮化合物互作的生化机制研究[D]. 湖北武汉: 华中农业大学硕士学位论文, 2022. Chen M. Research on the biochemical mechanism of the interaction between rhizobium nodD and plant flavonoids[D]. Wuhan, Hubei: MS Thesis of Huazhong Agricultural University, 2022.
[102] Feng M M, Adams J M, Fan K K, et al. Long-term fertilization influences community assembly processes of soil diazotrophs[J]. Soil Biology and Biochemistry, 2018, 126: 151−158. DOI: 10.1016/j.soilbio.2018.08.021
[103] Fan K K, Delgado-Baquerizo M, Guo X S, et al. Suppressed N fixation and diazotrophs after four decades of fertilization[J]. Microbiome, 2019, 7(1): 143. DOI: 10.1186/s40168-019-0757-8
[104] Zhou J, Ma M C, Guan D W, et al. Nitrogen has a greater influence than phosphorus on the diazotrophic community in two successive crop seasons in Northeast China[J]. Scientific Reports, 2021, 11(1): 6303. DOI: 10.1038/s41598-021-85829-8
[105] Menge D N L, Wolf A A, Funk J L. Diversity of nitrogen fixation strategies in Mediterranean legumes[J]. Nature Plants, 2015, 1(6): 15064. DOI: 10.1038/nplants.2015.64
[106] 何飞, 赵忠祥, 康俊梅, 等. 氮磷钾配比施肥对紫花苜蓿草产量及品质的影响[J]. 中国草地学报, 2019, 41(5): 24−32. He F, Zhao Z X, Kang J M, et al. Effects of N, P and K fertilizer on Alfalfa hay yield and quality[J]. Chinese Journal of Grassland, 2019, 41(5): 24−32.
[107] 齐敏兴, 刘晓静, 张晓磊, 刘艳楠. 不同磷水平对紫花苜蓿光合作用和根瘤固氮特性的影响[J]. 草地学报, 2013, 21(3): 512−516. Qi M X, Liu X J, Zhang X L, Liu Y N. Effects of different phosphorus levels on photosynthesis and root nodule nitrogen-fixing characteristic of Alfalfa.[J]. Acta Agrestia Sinica, 2013, 21(3): 512−516.
[108] 张晓红, 邹长明, 徐小康, 等. 磷肥对绿豆及其根瘤生长的影响研究[J]. 现代农业, 2014, (1): 28−29. Zhang X H, Zou C M, Xu X K, et al. Study on the effect of phosphorus fertilizer on the growth of mung bean and its root nodules[J]. Modern Agriculture, 2014, (1): 28−29.
[109] Reed S C, Seastedt T R, Mann C M, et al. Phosphorus fertilization stimulates nitrogen fixation and increases inorganic nitrogen concentrations in a restored prairie[J]. Applied Soil Ecology, 2007, 36(2/3): 238−242.
[110] Xiao D, Xiao L M, Che R X, et al. Phosphorus but not nitrogen addition significantly changes diazotroph diversity and community composition in typical karst grassland soil[J]. Agriculture, Ecosystems and Environment, 2020, 301: 106987. DOI: 10.1016/j.agee.2020.106987
[111] Mills M M, Ridame C, Davey M, et al. Iron and phosphorus co-limit nitrogen fixation in the eastern tropical North Atlantic[J]. Nature, 2004, 429: 292−294. DOI: 10.1038/nature02550
[112] Galloway J N, Dentener F J, Capone D G, et al. Nitrogen cycles: Past, present, and future[J]. Biogeochemistry, 2004, 70(2): 153−226. DOI: 10.1007/s10533-004-0370-0
[113] Capone D G. Marine nitrogen fixation: What’s the fuss?[J]. Current Opinion in Microbiology, 2001, 4(3): 341−348. DOI: 10.1016/S1369-5274(00)00215-0
[114] Zehr J P, Capone D G. Changing perspectives in marine nitrogen fixation[J]. Science, 2020, 368: 729.
[115] Hutchins D A, Capone D C. The marine nitrogen cycle: New developments and global change[J]. Nature Reviews Microbiology, 2022, 20(7): 401−414. DOI: 10.1038/s41579-022-00687-z
[116] Mohr W, Lehnen N, Ahmerkamp S, et al. Terrestrial-type nitrogen-fixing symbiosis between seagrass and a marine bacterium[J]. Nature, 2021, 600: 105−109. DOI: 10.1038/s41586-021-04063-4
[117] Coale T H, Loconte V, Turk-Kubo K A, et al. Nitrogen-fixing organelle in a marine alga[J]. Science, 2024, 384: 217−222. DOI: 10.1126/science.adk1075
[118] Zehr J P, Kudela R M. Nitrogen cycle of the open ocean: From genes to ecosystems[J]. Annual Review of Marine Science, 2011, 3(1): 197−225. DOI: 10.1146/annurev-marine-120709-142819
[119] Mahaffey C, Michaels A F, Capone D G. The conundrum of marine N2 fixation[J]. American Journal of Science, 2005, 305(6/8): 546−595.
[120] Glibert P M, Heli C A, Hollander D, et al. Evidence for dissolved organic nitrogen and phosphorus uptake during a cyanobacterial bloom in Florida Bay[J]. Marine Ecology Progress Series, 2004, 280: 73−83. DOI: 10.3354/meps280073
[121] Altabet M A, Francois R, Murray D W, Prell W L. Climate-related variations in denitrification in the Arabian Sea from sediment N14/N15 ratios[J]. Nature, 1995, 373: 506−509. DOI: 10.1038/373506a0
[122] Tschitschko B, Esti M, Philippi M, et al. Rhizobia-diatom symbiosis fixes missing nitrogen in the ocean[J]. Nature, 2024, 630: 899−904. DOI: 10.1038/s41586-024-07495-w
[123] Bozsoki Z, Gysel K, Hansen S B, et al. Ligand-recognizing motifs in plant LysM receptors are major determinants of specificity[J]. Science, 2020, 369: 663−670. DOI: 10.1126/science.abb3377
[124] Feng J, Lee T, Schiessl K, Oldroyd G E. Processing of NODULE INCEPTION controls the transition to nitrogen fixation in root nodules[J]. Science, 2021, 374: 629−632. DOI: 10.1126/science.abg2804
[125] Rübsam H, Krönauer C, Abel N B, et al. Nanobody-driven signaling reveals the core receptor complex in root nodule symbiosis[J]. Science, 2023, 379: 272−277. DOI: 10.1126/science.ade9204
[126] Abel N B, Nørgaard M M M, Hansen S B, et al. Phosphorylation of the alpha-I motif in SYMRK drives root nodule organogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2024, 121(8): e2311522121.
[127] Li Q, Zhang H W, Song Y, et al. Alanine synthesized by alanine dehydrogenase enables ammonium-tolerant nitrogen fixation in Paenibacillus sabinae T27[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(49): e2215855119.
[128] Turner T R, James E K, Poole P S. The plant microbiome[J]. Genome Biology, 2013, 14(6): 209. DOI: 10.1186/gb-2013-14-6-209
[129] Zhang N, Yang D Q, Wang D D, et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates[J]. BMC Genomics, 2015, 16(1): 685. DOI: 10.1186/s12864-015-1825-5
[130] 艾超, 赵远征, 张俪予, 等. 禾本科作物联合固氮研究进展[J]. 植物营养与肥料学报, 2024, 30(7): 1307−1321. DOI: 10.11674/zwyf.2024228 Ai C, Zhao Y Z, Zhang L Y, et al. Research progress on associative nitrogen fixation of gramineous crops[J]. Journal of Plant Nutrition and Fertilizers, 2024, 30(7): 1307−1321. DOI: 10.11674/zwyf.2024228
[131] Chai Y N, Schachtman D P. Root exudates impact plant performance under abiotic stress[J]. Trends in Plant Science, 2021, 27(1): 80−91.
[132] Qiao M J, Sun R B, Wang Z X, et al. Legume rhizodeposition promotes nitrogen fixation by soil microbiota under crop diversification[J]. Nature Communications, 2024, 15(1): 3535. DOI: 10.1038/s41467-024-47979-x
[133] Yan D W, Tajima H, Cline L C, et al. Genetic modification of flavone biosynthesis in rice enhances biofilm formation of soil diazotrophic bacteria and biological nitrogen fixation[J]. Plant Biotechnology Journal, 2022, 20(11): 2135−2148. DOI: 10.1111/pbi.13894
[134] Xiao A F, Wu J S, Wang W Y, et al. Soybean ethylene response factors GmENS1 and GmENS2 promote nodule senescence[J]. Plant Physiology, 2024, 196(2): 1029−1041. DOI: 10.1093/plphys/kiae363
[135] Wang L L, Rubio M C, Xin X, et al. CRISPR/Cas9 knockout of leghemoglobin genes in Lotus japonicus uncovers their synergistic roles in symbiotic nitrogen fixation[J]. The New Phytologist, 2019, 224(2): 818−832. DOI: 10.1111/nph.16077
[136] Batista M B, Dixon R. Manipulating nitrogen regulation in diazotrophic bacteria for agronomic benefit[J]. Biochemical Society Transactions, 2019, 47(2): 603−614. DOI: 10.1042/BST20180342
[137] Beatty P H, Good A G. Future prospects for cereals that fix nitrogen[J]. Science, 2011, 333: 416−417. DOI: 10.1126/science.1209467
[138] Griesmann M, Chang Y, Liu X, et al. Phylogenomics reveals multiple losses of nitrogen-fixing root nodule symbiosis[J]. Science, 2018, 361: 1743. DOI: 10.1126/science.aat1743
[139] Gaby J C, Buckley D H. A global census of nitrogenase diversity[J]. Environmental Microbiology, 2011, 13(7): 1790−1799. DOI: 10.1111/j.1462-2920.2011.02488.x
[140] Burén S, López-Torrejón G, Rubio L M. Extreme bioengineering to meet the nitrogen challenge[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(36): 8849−8851.
[141] Vicente E J, Dean D R. Keeping the nitrogen-fixation dream alive[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(12): 3009−3011.
[142] van Velzen R, Holmer R, Bu F J, et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(20): E4700−E4709.
[143] Burén S, Young E M, Sweeny E A, et al. Formation of nitrogenase nifDK tetramers in the mitochondria of Saccharomyces cerevisiae[J]. ACS Synthetic Biology, 2017, 6(6): 1043−1055. DOI: 10.1021/acssynbio.6b00371
[144] Oldroyd G E D, Dixon R. Biotechnological solutions to the nitrogen problem[J]. Current Opinion in Biotechnology, 2014, 26: 19−24. DOI: 10.1016/j.copbio.2013.08.006
[145] Soto G, Fox A R, Ayub A N. Exploring the intrinsic limits of nitrogenase transfer from bacteria to eukaryotes[J]. Journal of Molecular Evolution, 2013, 77(1/2): 3−7.
[146] Ivleva N B, Groat J, Staub J M, Stephens M. Expression of active subunit of nitrogenase via integration into plant organelle genome[J]. PLoS ONE, 2016, 11(8): e0160951. DOI: 10.1371/journal.pone.0160951
[147] Yang S Q, Bisseling T. Is it possible to engineer nitrogen fixing nodule symbiosis?[J]. Agriculture Communications, 2024, 2(1): 100031−100040. DOI: 10.1016/j.agrcom.2024.100031
[148] van Heerwaarden J, Baijukya F, Kyei-Boahen S, et al. Soyabean response to rhizobium inoculation across sub-Saharan Africa: Patterns of variation and the role of promiscuity[J]. Agriculture, Ecosystems and Environment, 2018, 261: 211−218. DOI: 10.1016/j.agee.2017.08.016
[149] Córdova S C, Castellano M J, Dietzel R, et al. Soybean nitrogen fixation dynamics in Iowa, USA[J]. Field Crops Research, 2019, 236: 165−176. DOI: 10.1016/j.fcr.2019.03.018
[150] Pastor-Bueis R, Sánchez-Cañizares C, James E K, González-Andrés F. Formulation of a highly effective inoculant for common bean based on an autochthonous elite strain of Rhizobium leguminosarum bv. phaseoli, and genomic-based insights into its agronomic performance[J]. Frontiers in Microbiology, 2019, 10: 2724. DOI: 10.3389/fmicb.2019.02724
[151] Straub D, Rothballer M, Hartmann A, Ludewig U. The genome of the endophytic bacterium H. frisingense GSF30T identifies diverse strategies in the Herbaspirillum genus to interact with plants[J]. Frontiers in Microbiology, 2013, 4: 168.
[152] Li Y B, Li Q, Guan G H, Chen S F. Phosphate solubilizing bacteria stimulate wheat rhizosphere and endosphere biological nitrogen fixation by improving phosphorus content[J]. PeerJ, 2020, 8: e9062. DOI: 10.7717/peerj.9062
[153] Adesemoye A O, Torbert H A, Kloepper J W. Plant growth-promoting rhizobacteria allow reduced application rates of chemical fertilizers[J]. Microbial Ecology, 2009, 58(4): 921−929. DOI: 10.1007/s00248-009-9531-y
[154] 张瑞福, 陈玉, 孙新丽, 等. 中国生物肥料与有机肥料研究三十年: 回顾与展望[J]. 植物营养与肥料学报, 2024, 30(7): 1262−1273. DOI: 10.11674/zwyf.2024297 Zhang R F, Chen Y, Sun X L, et al. Biofertilizer and organic fertilizer research over thirty years in China: Retrospect and prospect[J]. Journal of Plant Nutrition and Fertilizers, 2024, 30(7): 1262−1273. DOI: 10.11674/zwyf.2024297




 下载:
下载: