Hyperspectral response characteristics and correlation analysis of grape leaf tissue structure
-
摘要:目的
研究不同葡萄品种叶片组织结构特征及其光谱响应差异,揭示葡萄叶片光谱反射率差异的主要影响因素,为提高葡萄叶片营养光谱诊断精度提供参考。
方法在河北廊坊葡萄园,采集夏黑、意大利、红宝石、秋黑4个葡萄品种的叶片,用Fieldspec FR2500光谱仪测定叶片光谱数据,常规化学方法测定叶片含氮量,通过扫描电镜 (SU8010) 冷冻传输技术观察和测量叶片组织结构,进行不同葡萄品种的叶片光谱与叶片组织结构的相关分析。
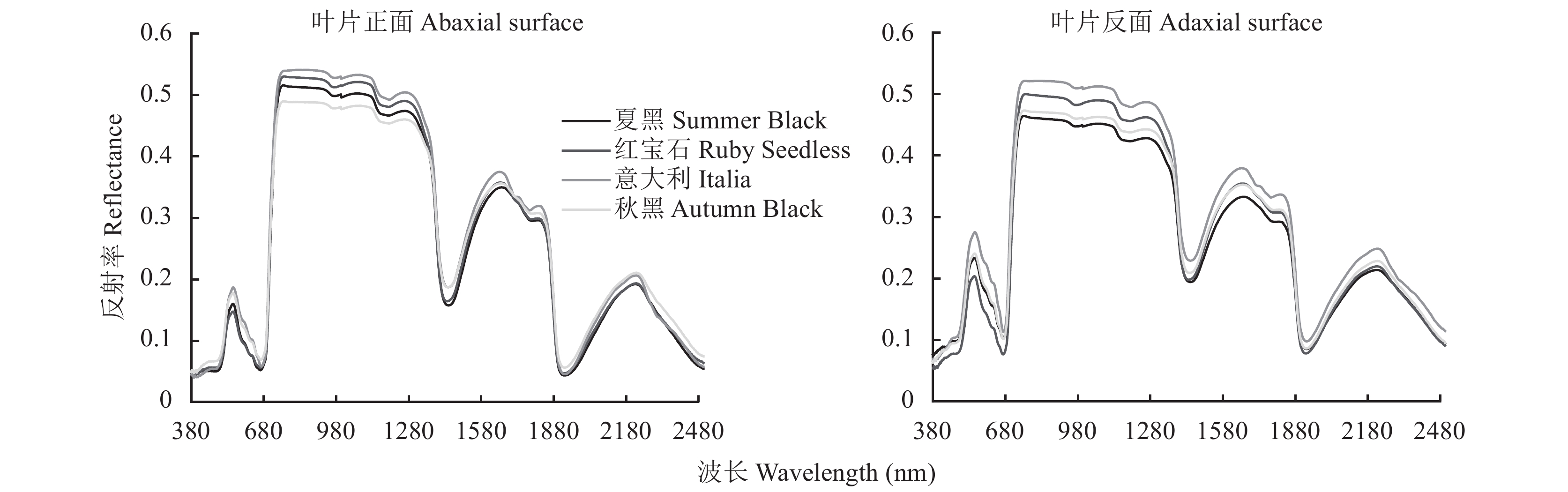
结果葡萄叶片气孔主要分布在叶片反面,是正反面光谱反射率产生差异的主要原因,在可见光波段范围内,叶片反面光谱反射率皆高于叶片正面光谱反射率,在近红外波段范围,叶片正面光谱反射率普遍高于叶片反面光谱反射率;不同葡萄品种叶片表面气孔数量和分布不同,栅栏组织细胞厚度以及海绵组织厚度存在差异,在叶片含氮量相近条件下,不同品种的光谱反射率曲线有差异,主要是叶片组织结构和形态差异所致;叶片正面光谱的红边参数λred (在660~770 nm波长范围内,当光谱反射率的一阶微分值达最大时所对应的波长) 与不同品种叶片厚度相关性均达到显著或极显著水平,光谱红边参数与其它叶片结构参数也有较强相关性,其中栅栏组织和海绵组织的厚度在不同品种的光谱响应中是不可忽略的因素。
结论明确了叶片正反面表皮细胞形态、叶片内部结构差异及其与光谱特征的相关性,不同葡萄品种叶片厚度变化均可以用红边参数λred来反映,但若考虑品种因素,还可以针对每个品种选择相关性更好的参数,这为后期葡萄叶片营养光谱诊断模型的建立和优化提供了依据:为提高叶片营养光谱诊断模型的精度,在利用光谱技术进行叶片营养诊断时需要考虑叶片结构因素的影响。
Abstract:ObjectivesThe spectral response of leaf tissue structure in different grape cultivars was investigated. The study aimed to identify the main factors responsible for spectral differences in grape leaves and advance spectral diagnosis accuracy in leaf nutrition.
MethodsThe experiment was conducted in Langfang vineyard, Hebei Province. The leaves of four grape cultivars, Summer Black, Italia, Ruby Seedless and Autumn Black, were sampled regularly during the study period. The spectral data and N content were determined synchronously using FieldSpec FR2500 spectrometer and chemical method, respectively. The leaf tissue structures were observed and measured using scanning electron microscopy (SU8010) cryopreservation technology. The correlation between the spectrum and tissue structure of the leaves was calculated.
ResultsThe spectral difference between the leaf′s front and back was caused by the distribution of stomata in the reverse side of the grape leaves. In the visible band, the leaf back′s spectral reflectance was higher than that of the leaf front. However, it is the opposite in the near-infrared band, and the leaf front's spectral reflectance was higher than that of the leaf back. The cultivars exhibited differences in spectral reflectance when leaf N content was similar due to variation in the number and distribution of stomata on the leaf surface, the thickness of palisade tissue cells, and the thickness of sponge tissues. The correlation between the red edge parameters λred of the front (i.e., the wavelength at which the first differential value of spectral reflectance reaches the maximum range in 660–770 nm) and the leaf thickness of the different varieties was significantly different. In addition, there was a strong correlation between the spectral red edge parameters and other leaf structural parameters, among which the thickness of palisade tissue and spongy tissue was a non-negligible factor in the spectral response of the grape varieties.
ConclusionsThe differences in cell morphology on the front and back surfaces of the leaves, internal structure of leaves and their correlation with spectral characteristics are determined. We find that the red edge parameter λred can show the leaf thickness of different grape varieties. If the variety factor is considered, some parameters with better correlation can also be selected for each variety. These results provided a basis for establishing and optimising the leaf nutrient diagnosis spectral model in grape. For improving the accuracy of the leaf nitrogen diagnostic model, the influence of leaf structure should be considered when using the spectral technique to diagnose leaf nutrition.
-
Keywords:
- grape /
- hyperspectral /
- SEM /
- nitrogen /
- leaf structure
-
科学施肥是保证葡萄树体正常生长及生产优质果实的基础,而高效的营养诊断技术则是及时、合理施肥的前提。葡萄植株上常用的营养诊断方法有树相诊断法、土壤化学分析和植物诊断法等。1926年法国 Lagalu和Maume 认为,叶片是植物体内营养元素含量反应变化最为敏感的部位,从而首次提出“叶诊断”技术。且同一植物正常条件下在一定时期叶内营养元素含量是相对稳定的,只是不同矿质元素含量的相对稳定时期略有不同[1-2]。传统的氮素营养诊断方法以化学测定为主,测定过程耗时长,过程复杂;而高光谱由于其超多波段 (350~2500 nm)、高分辨率 (3~10 nm) 的优势为实现作物无损、快速、实时营养诊断提供了有效方法,在技术上也相对比较成熟。Gerbbers等[3]发表在《Science》上的文章提出可见/近红外高光谱技术是推进精确农业发展和解决粮食安全问题的关键技术。高光谱技术获取的漫反射光谱包含着反射物结构和组成的丰富信息,是植被信息获得的重要手段[4],在可见和近红外波段,受植物叶片叶绿素含量、氮素含量、叶片结构和叶片结构成分对近红外辐射多次散射影响控制[5-7]。植物缺氮时,蛋白质合成受阻,导致蛋白质和酶的数量下降,叶绿体结构遭到破坏;而氮素过量时,常使细胞增长过大,细胞壁薄。由此可见,氮素的丰缺变化影响着叶片氮素及其相关参数的变化,同时叶片内部结构也会发生相应的变化,而叶片结构也正是引起光谱变化的另一个重要因素。以往氮素营养水平高光谱诊断以植物体内氮素敏感光谱的反射率与氮浓度的相关关系为基础,未考虑叶片表面和内部结构对光谱响应的影响。了解叶片形态和组织结构特征可以更精确地解释叶片的光谱响应。Vogelmann等[8]指出,长圆柱形栅栏叶肉细胞将光波传播到叶片内部更深处,而球形的海绵状叶肉细胞则倾向于散射辐射。张友玉等[9]发现烟草不同部位的叶片内部组织结构存在某些规律差异;Wagner等[10]发现拟南芥叶片海绵组织的叶绿素a/b的比值低于栅栏组织;有学者发现在反射率光谱的近红外区域,叶片的厚度与反射率有很强的相关性[11-13]。这些研究都证明不仅叶片表面形态会影响叶片光谱反射率,叶片厚度和内部结构同样对光谱反射率有较大影响,尤其是对于有穿透性的近红外波段的影响。本研究基于叶片光谱响应的主要影响因素,探索在叶片含氮量相近的条件下,不同葡萄品种叶片表面和内部细胞结构和形态特征差异及其光谱响应,揭示影响葡萄叶片光谱反射率差异的主要因素,为以叶片诊断为目的的光谱数据分析提供参考依据,提高葡萄叶片氮素营养光谱诊断精度。
1. 材料与方法
1.1 试验地概况和试验材料
试验地位于河北省廊坊市中国农业科学院试验园 (116°35′19.51″E、39°35′51.75″N),年平均气温11.9℃,平均无霜期183天;葡萄的种植管理方式采用限域栽培、塑料大棚避雨和架式立体栽培,正常水肥管理。供试验的葡萄品种有夏黑、意大利、红宝石、秋黑。
1.2 样品采集和化学测定
样品采集:在有果穗时,尽量采取果穗对生叶,否则采取成熟叶,每个测定时期每个品种进行光谱和理化参数的测定,同时,取嫩叶与样品进行扫描电镜观察。
叶片含氮量测定:光谱测定结束后,将被测叶片在105℃杀青30 min,然后75℃烘干至恒重,研磨至粉末状,采用H2SO4-H2O2法消化,AA3流动注射分析仪 (德国 SEAL) 测定含氮量。
1.3 光谱数据获取
高光谱仪:美国ASD公司 Fieldspec FR2500便携式光谱仪,可用于野外监测与室内光谱测定。光谱范围为350~2500 nm;光谱采样间隔和分辨率分别为1.4和3 nm (300~1000 nm),2和10 nm (1000~2500 nm);波长精度为1 nm;固定扫描时间为0.1 s。
叶片光谱测定:开花后每隔15天左右进行取样测定。测定时,采用专用ASD高光谱仪叶片探头 (内置光源,自带黑、白板),以夹持叶片的方式对每个叶片进行测定,测定叶片时黑板为背景板,测定部位为叶片基部、中部和尖部,并且避开较大的叶脉,待每个点光谱曲线稳定后扫描2次,共6次,叶片光谱反射率取其平均值,每片叶测定完用白板 (参考板) 进行校正,并采集参考板反射率。
1.4 叶片结构信息获取
在刚离体的葡萄叶片上切取两片4 mm × 4 mm大小的方块,立即用去离子水清洗后,用戊二醛浸泡样品 (4℃) 8 h以上,固定细胞;然后吸出戊二醛固定液,经过去离子水和乙醇反复浸泡后,将样品放入CO2临界点干燥器内完成样品干燥;干燥后的样品用导电胶粘在电镜样品台上,在扫描电镜 (日立SU-8010) 下观察、测量及拍摄图片。
1.5 数据处理
用ViewSpecPro5.7光谱处理软件处理光谱数据,Excel 2007进行数据分析和作图,Image J进行电镜数据测量,Origin 2018进行数据分析和作图,SPSS 21软件进行统计分析。
2. 结果与分析
2.1 不同品种葡萄叶片光谱反射率变化
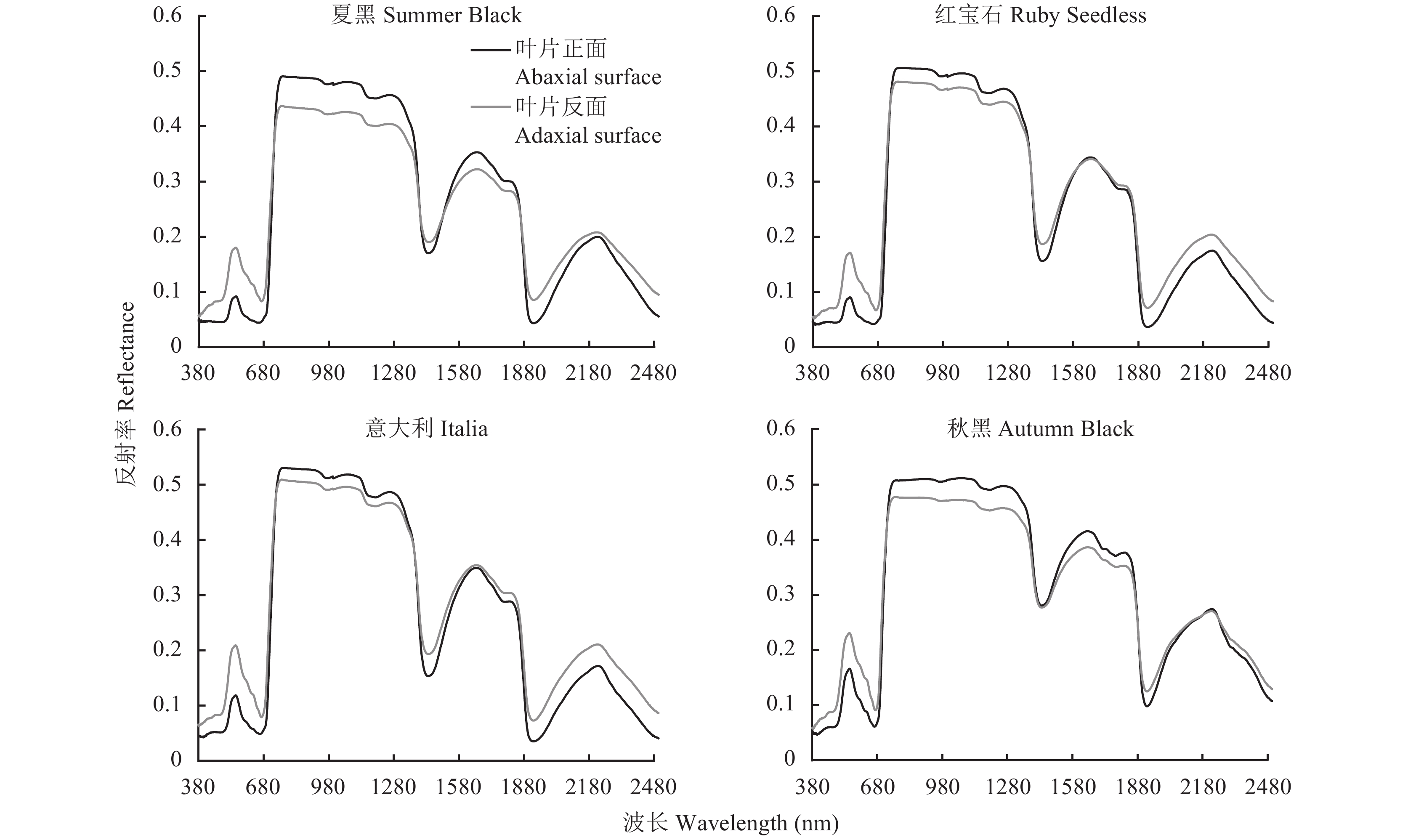
从图1可以看出,同一葡萄叶片在可见光波段 (380~680 nm)表现为叶片反面光谱反射率高于正面光谱反射率,而在近红外波段 (780~1300 nm),则表现为叶片正面光谱反射率普遍高于反面光谱反射率,在不同葡萄品种中均表现为如此。选取相近叶片氮素含量下的不同葡萄品种叶片进行分析。由图2可以看出,在可见光波段,叶片反面光谱反射率普遍高于正面光谱反射率,说明可见光波段受叶片表皮气孔的影响较大;在近红外波段,不同葡萄品种叶片的光谱反射率存在明显差异,但并没有表现正反面差异,而是更大程度上受到叶片内部组织结构影响。叶片正面光谱曲线中,4个葡萄品种光谱反射率差异不大;叶片反面光谱曲线中,意大利叶片反面光谱反射最大,夏黑与秋黑叶片光谱反射率接近。
2.2 不同葡萄品种叶片SEM图像分析
图3是葡萄叶片在扫描电镜下1.0 kv电压下放大500倍观察和拍摄到的图片,从图片中可以看出,葡萄叶片的气孔主要分布在叶片的反面,气孔的形态与分布并不规则;正面表皮细胞较反面表皮细胞的排列更整齐,细胞形态更规则。从叶龄看,老叶表皮细胞大而少,而嫩叶表皮细胞小而多,而且排列较紧密。不同叶龄叶片及其正反面差异在不同品种中均表现相似,只是不同品种表皮细胞形态、气孔大小和分布有所不同。例如,秋黑的老叶相对其它品种表皮细胞更大,而红宝石叶片反面气孔分布更密集。
2.3 不同葡萄叶片横切面组织结构差异
图4是叶片横切面扫描电镜下拍摄的照片,左边为嫩叶,右边为老叶。从叶片横切面扫描图像可以看出,夏黑与秋黑两个品种的老叶与嫩叶的主要差别在于栅栏组织的厚度随着叶龄的增加显著增加,海绵组织的厚度并无显著差别,但夏黑叶片栅栏组织的增长较显著;而在红宝石品种中,栅栏组织与海绵组织都会随着叶龄的增加而增加,但栅栏组织厚度增长较海绵组织厚度增长幅度大;在意大利品种中,栅栏组织与海绵组织都会随着叶龄的增加而增加。
2.4 叶片组织结构与红边参数的相关分析
“红边”是植物光谱响应的一个经典参数,在估测叶绿素含量与氮素营养状况方面具有良好表现[14-15]。通过计算光谱反射率在660~770 nm波段的一阶微分来计算红边参数,这些参数[16]包括:红边位置,在660~770 nm波长范围内,当光谱反射率的一阶微分值达最大时所对应的波长 (λred) λred = λi[Max R′(λ)](λ∈660~770 nm);红吸收峰,红光波段的反射率最小点,即660~770 nm波段反射率最小处的波长值 (λo);红边振幅,当波长为红边时的一阶微分值 (dλred);最小振幅,波长在660~770 nm的最小一阶微分值 (dλmin);红边峰值面积,660~770 nm波段的光谱一阶微分值包围的面积 (∑dλ660~770)。
由表1可以得知,红边光谱特征参数与叶片结构参数存在着不同程度的相关性,夏黑叶片正面光谱的红边参数与栅栏组织厚度、叶片厚度达到了显著相关 (P < 0.05),叶片反面光谱的红边参数与栅栏组织厚度、海绵组织厚度和叶片厚度达到显著相关 (P < 0.05);意大利叶片正面光谱的红边参数与上表皮厚度达到极显著相关 (P < 0.01),与叶片厚度达到显著相关 (P < 0.05),叶片反面光谱的红边参数与上表皮厚度、下表皮厚度达到极显著相关 (P < 0.01);红宝石叶片正面光谱的红边参数与栅栏组织厚度、叶片厚度达到了极显著相关 (P < 0.01),与海绵组织达到显著相关 (P < 0.05),叶片反面光谱的红边参数与下表皮厚度达到显著相关 (P < 0.05);秋黑叶片正面光谱的红边参数与栅栏组织厚度、海绵组织厚度和叶片厚度达到极显著相关 (P < 0.01),叶片反面光谱的红边参数与栅栏组织厚度达到极显著相关 (P < 0.01),与海绵组织厚度和叶片厚度达到显著相关 (P < 0.05)。
表 1 叶片组织结构与红边参数的相关分析Table 1. Leaf tissue structure and red edge parameters correlation analysis品种
Cultivar叶片部位
Leaf position叶片组织结构指标
Leaf tissue structure index红边参数类型
Red edge parameter type相关系数
r夏黑 Summer Black 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.800* 叶片厚度 Leaf thickness λred –0.851* 反面 Adaxial surface 栅栏组织厚度 Palisade tissue thickness dλmin –0.836* 栅栏组织厚度 Palisade tissue thickness λo 0.773* 栅栏组织厚度 Palisade tissue thickness λred –0.819* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.781* 海绵组织厚度 Sponge tissue thickness dλred 0.774* 叶片厚度 Leaf thickness dλmin –0.781* 意大利 Italia 正面 Abaxial surface 上表皮厚度 Upper epidermis thickness λo –0.891** 上表皮厚度 Upper epidermis thickness λred 0.794* 叶片厚度 Leaf thickness λred 0.821* 叶片厚度 Leaf thickness λo –0.765* 反面 Adaxial surface 上表皮厚度 Upper epidermis thickness λo –0.879** 上表皮厚度 Upper epidermis thickness dλmin 0.844* 下表皮厚度 Lower epidermis thickness ∑dλ660~770 0.891** 红宝石 Ruby Seedless 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.909** 栅栏组织厚度 Palisade tissue thickness dλmin –0.834* 海绵组织厚度 Sponge tissue thickness λred –0.814* 叶片厚度 Leaf thickness λred –0.887** 反面 Adaxial surface 下表皮厚度 Lower epidermis thickness λo –0.790* 秋黑 Autumn Black 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness ∑dλ660~770 –0.895** 栅栏组织厚度 Palisade tissue thickness λred –0.759* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.920** 海绵组织厚度 Sponge tissue thickness λred –0.835* 叶片厚度 Leaf thickness ∑dλ660~770 –0.910** 叶片厚度 Leaf thickness λred –0.839* 反面 Adaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.905** 栅栏组织厚度 Palisade tissue thickness ∑dλ660~770 –0.846* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.762* 叶片厚度 Leaf thickness ∑dλ660~770 –0.817* 注(Note):*—P < 0.05; **—P < 0.01. 3. 讨论
葡萄营养诊断一般常采用“叶分析”的方法,传统的叶分析是采用化学方法进行叶片养分含量的测定,而用于野外条件下测定的高光谱技术可以实现快速、无损、实时的活体原位测定,对于葡萄营养的及时调控提供了有效的技术手段。在利用叶片光谱来反演某种养分信息的时候,其光谱响应除了与叶片养分有关,还与叶片表面和内部细胞形态和结构特征有关,这也是许多叶片光谱测定仪数据不稳定的主要原因,比如日本产的SPAD-502在应用中往往受品种、生育期以及其它生长条件的影响而出现不稳定的现象[17-18]。通常利用遥感平台测量叶片遥感数据时,虽然大部分数据来自于植被叶片的正面,但也有部分反射信息由于冠层结构以及叶片倾斜的关系而来自于叶片反面,而叶片反面会影响在遥感平台所获取的光谱信息[19],且植被冠层的反射率由于内部阴影和多重散射会在光谱上产生强烈的非线性影响[20],从而可能导致测量偏差[21],利用内置光源夹持测定的方法,可以直接获取叶片与入射光之间的反射率或者透射率信号,这些信号直接来源于目标叶片,不受冠层结构的影响[22],但是除了叶片成分因素外,叶片的厚度、表皮细胞形态以及内部组织结构等特征是影响叶片光谱的另一主要因素。
通过对叶片表面信息与叶片光谱数据的观察,可以发现葡萄叶片气孔主要分布在叶片反面,且反面表皮细胞形状和排列大多不规则,气孔大小和分布也有所不同,该结果很好地解释了图1中叶片正反面光谱的差异,正反面光谱反射率的差异恰好是由于叶片正反表面细胞形态的影响,其中气孔是主要的影响因素,即气孔的形态、分布以及气孔形成的一些暗影等导致的,因为同一叶片其它成分信息是相同的。
由于近红外波段反射光谱是透射到叶片内部经过吸收、折射、散射,最终获取的反射光谱,其携带了叶片内部组织结构、细胞大小和形态等信息。通过对叶片结构观察发现,栅栏组织较紧密,空隙较小,而海绵组织空隙较多也较大,组织疏松[23-24]。因此叶肉结构的差异与气孔的分布与数量不同,导致了不同葡萄品种之间叶片正反面光谱在近红外波段的显著差异。部分研究者认为叶片的光谱特征与叶肉细胞结构具有较强的相关性[25-27],本研究通过对叶片组织结构与红边参数进行相关性分析发现,葡萄叶片光谱反射率所构建的红边参数中,大多都与叶肉组织细胞厚度达到显著相关。
叶片表面形态、内部结构是光谱反射率影响因素之一,是利用光谱技术对叶片进行理化性状的监测时不可忽略的因素。本研究初步揭示了叶片结构特征参数光谱响应特征及其相关性,进一步将会在建立叶片营养光谱诊断模型时将叶片结构因素考虑进去,从而达到优化模型精度的目的。
4. 结论
1)葡萄叶片正反面光谱响应的差异主要与气孔数量和分布有关,与叶片正面相比,叶片反面气孔数量多,光谱在可见光波段光谱反射率高,近红外波段光谱反射率低。
2) 除叶片表面细胞形态、大小和数量的差异外,叶片横切面的栅栏组织、海绵组织以及表皮细胞厚度在不同葡萄品种中均有差异,是不同品种光谱反射率差异的影响因素之一。
3) 红边参数λred可以反映不同葡萄品种叶片厚度的变化,为不同品种可以采用同一个优化参数提供了可能,但针对具体某个品种而言,还可以选择其它相关性更好的参数。
-
表 1 叶片组织结构与红边参数的相关分析
Table 1 Leaf tissue structure and red edge parameters correlation analysis
品种
Cultivar叶片部位
Leaf position叶片组织结构指标
Leaf tissue structure index红边参数类型
Red edge parameter type相关系数
r夏黑 Summer Black 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.800* 叶片厚度 Leaf thickness λred –0.851* 反面 Adaxial surface 栅栏组织厚度 Palisade tissue thickness dλmin –0.836* 栅栏组织厚度 Palisade tissue thickness λo 0.773* 栅栏组织厚度 Palisade tissue thickness λred –0.819* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.781* 海绵组织厚度 Sponge tissue thickness dλred 0.774* 叶片厚度 Leaf thickness dλmin –0.781* 意大利 Italia 正面 Abaxial surface 上表皮厚度 Upper epidermis thickness λo –0.891** 上表皮厚度 Upper epidermis thickness λred 0.794* 叶片厚度 Leaf thickness λred 0.821* 叶片厚度 Leaf thickness λo –0.765* 反面 Adaxial surface 上表皮厚度 Upper epidermis thickness λo –0.879** 上表皮厚度 Upper epidermis thickness dλmin 0.844* 下表皮厚度 Lower epidermis thickness ∑dλ660~770 0.891** 红宝石 Ruby Seedless 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.909** 栅栏组织厚度 Palisade tissue thickness dλmin –0.834* 海绵组织厚度 Sponge tissue thickness λred –0.814* 叶片厚度 Leaf thickness λred –0.887** 反面 Adaxial surface 下表皮厚度 Lower epidermis thickness λo –0.790* 秋黑 Autumn Black 正面 Abaxial surface 栅栏组织厚度 Palisade tissue thickness ∑dλ660~770 –0.895** 栅栏组织厚度 Palisade tissue thickness λred –0.759* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.920** 海绵组织厚度 Sponge tissue thickness λred –0.835* 叶片厚度 Leaf thickness ∑dλ660~770 –0.910** 叶片厚度 Leaf thickness λred –0.839* 反面 Adaxial surface 栅栏组织厚度 Palisade tissue thickness λred –0.905** 栅栏组织厚度 Palisade tissue thickness ∑dλ660~770 –0.846* 海绵组织厚度 Sponge tissue thickness ∑dλ660~770 –0.762* 叶片厚度 Leaf thickness ∑dλ660~770 –0.817* 注(Note):*—P < 0.05; **—P < 0.01. -
[1] 蒋万峰, 崔永峰, 张卫东, 等. 无核白葡萄叶内矿质元素含量年生长季内的变化[J]. 西北农林科技大学学报(自然科学版), 2005, 33(8): 91–95. Jiang W F, Cui Y F, Zhang W D, et al. Annual changes of mineral elements in foliar of thompsons seedless[J]. Journal of Northwest A& F University (Natural Science Edition), 2005, 33(8): 91–95.
[2] 陈刚, 杨静荣, 建德锋, 等. 碧香无核葡萄的叶分析营养诊断研究[J]. 北方园艺, 2007, (8): 22–24. DOI: 10.3969/j.issn.1001-0009.2007.08.010 Chen G, Yang J R, Jian D F, et al. Study on the nutrition diagnosis of Bixiangwuhe grape by leaf analysis[J]. Northern Horticulture, 2007, (8): 22–24. DOI: 10.3969/j.issn.1001-0009.2007.08.010
[3] Gerbbers R, Adamchuk V I. Precision agriculture and food security[J]. Science, 2010, 327: 828–831. DOI: 10.1126/science.1183899
[4] 浦瑞良, 宫鹏. 高光谱遥感及其应用[M]. 北京: 高等教育出版社, 2000. 82–86. Pu R L, Gong P. Hyperspectral remote sensing and its applications[M]. Beijing: Higher Education Press, 2000. 82–86.
[5] Stellacci A, Castrignanò A, Troccoli A, et al. Selecting optimal hyperspectral bands to discriminate nitrogen status in durum wheat: A comparison of statistical approaches[J]. Environmental Monitoring & Assessment, 2016, 188(3): 199.
[6] Curran P J, Dungan J L, Peterson D L. Estimating the foliar biochemical concentration of leaves with reflectance spectrometry[J]. Remote Sensing of Environment, 2001, 76(3): 349–359. DOI: 10.1016/S0034-4257(01)00182-1
[7] Lu Y L, Bai Y L, Ma D L, et al. Nitrogen vertical distribution and status estimation using spectral data in maize[J]. Communications in Soil Science & Plant Analysis, 2018, 49(5): 526–536.
[8] Vogelmann T C, Martin G. The functional significance of palisade tissue: Penetration of directional versus diffuse light[J]. Plant, Cell & Environment, 1993, 16(1): 65–72.
[9] 张友玉, 陈良碧. 烟草叶片组织结构的扫描电镜观察方法[J]. 电子显微学报, 2000, 19(2): 154–157. Zhang Y Y, Chen L B. Observation of the structure of tobacco leaf tissue with SEM[J]. Journal of Chinese Electron Microscopy Society, 2000, 19(2): 154–157.
[10] Wagner R, Dietzel L, Brutigam K, et al. The long-term response to fluctuating light quality is an important and distinct light acclimation mechanism that supports survival of Arabidopsis thaliana under low light conditions[J]. Planta, 2008, 228(4): 573–587. DOI: 10.1007/s00425-008-0760-y
[11] Knapp A K, Carter G A. Variability in leaf optical properties among 26 species from a broad range of habitats[J]. American Journal of Botany, 1998, 85(7): 940–946. DOI: 10.2307/2446360
[12] Katja K, Mojca M, Alenka G. Heterophylly results in a variety of “spectral signatures” in aquatic plant species[J]. Aquatic Botany, 2012, 98(1): 20–26. DOI: 10.1016/j.aquabot.2011.12.004
[13] Ourcival J M, Joffre R, Rambal S. Exploring the relationships between reflectance and anatomical and biochemical properties in Quercus ilex leaves[J]. New Phytologist, 2010, 143(2): 351–364.
[14] 王秀珍, 王人潮, 黄敬峰. 微分光谱遥感及其在水稻农学参数测定上的应用研究[J]. 农业工程学报, 2002, 18(1): 9–13. DOI: 10.3321/j.issn:1002-6819.2002.01.003 Wang X Z, Wang R C, Huang J F. Derivative spectrum remote sensing and its application in measurement of rice agronomic parameters of rice[J]. Transactions of the Chinese Society of Agricultural Engineering, 2002, 18(1): 9–13. DOI: 10.3321/j.issn:1002-6819.2002.01.003
[15] Takebe M, Yoneyama T, Inada K, et al. Spectral reflectance ratio of rice canopy for estimating crop nitrogen status[J]. Plant & Soil, 1990, 122(2): 295–297.
[16] 黄文江, 赵春江, 王纪华, 等. 红边参数在作物营养诊断和品质预报上的应用[J]. 农业工程学报, 2004, 20(6): 1–5. DOI: 10.3321/j.issn:1002-6819.2004.06.001 Huang W J, Zhao C J, Wang J H, et al. Application of red edge variables to nutrition diagnosis and grain quality forecast of winter wheat[J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20(6): 1–5. DOI: 10.3321/j.issn:1002-6819.2004.06.001
[17] Campbell R J, Mobley K N, Marini R P, et al. Growing conditions alter the relationship between SPAD-501 values and apple leaf chlorophyll[J]. Publication of the American Society for Horticultural Science, 1990, 63(3): 330–331.
[18] Schepers J S, Francis D D, Vigil M, et al. Comparison of corn leaf nitrogen concentration and chlorophyll meter readings[J]. Communications in Soil Science and Plant Analysis, 1992, 23(17–20): 2173–2187. DOI: 10.1080/00103629209368733
[19] Campbell P K E, Middleton E M, Mcmurtrey J E, et al. Assessment of vegetation stress using reflectance or fluorescence measurements[J]. Journal of Environmental Quality, 2007, 36(3): 832–845. DOI: 10.2134/jeq2005.0396
[20] Verhoef W, Bach H. Simulation of hyperspectral and directional radiance images using coupled biophysical and atmospheric radiative transfer models[J]. Remote Sensing of Environment, 2003, 87(1): 23–41. DOI: 10.1016/S0034-4257(03)00143-3
[21] Ollinger S V. Sources of variability in canopy reflectance and the convergent properties of plants[J]. New Phytologist, 2011, 189(2): 375–394. DOI: 10.1111/j.1469-8137.2010.03536.x
[22] Makdessi N A, Jean P A, Ecarnot M, et al. How plant structure impacts the biochemical leaf traits assessment from in-field hyperspectral images: A simulation study based on light propagation modeling in 3D virtual wheat scenes[J]. Field Crops Research, 2017, 205: 95–105. DOI: 10.1016/j.fcr.2017.02.001
[23] 王宝华, 吴帼英, 黄静勋. 烟叶植物学特性的观察Ⅱ. 烤烟烟叶的栅栏组织和海绵组织[J]. 中国烟草科学, 1984, (2): 10–15. Wang B H, Wu G Y, Huang J X. Observation of tobacco leaf botany features Ⅱ. Flue-cured tobacco leaves and their palisade tissue and spongy tissue[J]. Chinese Tobacco Science, 1984, (2): 10–15.
[24] 智磊, 罗定棋, 熊莹, 等. 施氮量对烤烟叶片组织结构和细胞发育的影响[J]. 烟草科技, 2012, (7): 81–85. DOI: 10.3969/j.issn.1002-0861.2012.07.018 Zhi L, Luo D Q, Xiong Y, et al. Effects of nitrogen application rates on tissue structure and cell development of flue-cured tobacco leaves[J]. Tobacco Science & Technology, 2012, (7): 81–85. DOI: 10.3969/j.issn.1002-0861.2012.07.018
[25] Shi R H, Zhuang D F, Niu Z. Simulated hyperspectral data analysis using continuum removal: Case study on leaf chlorophyll prediction [A]. IEEE 2006 8th International Conference on Signal Processing[C]. New York: IEEE, 2007.
[26] Karen C, Sanchez-Azofeifa G. Changes in spectral properties, chlorophyll content and internal mesophyll structure of senescing Populus balsamifera and Populus tremuloides leaves[J]. Sensors, 2008, 8(1): 51–69. DOI: 10.3390/s8010051
[27] 梁守真, 施平, 马万栋, 等. 植被叶片光谱及红边特征与叶片生化组分关系的分析[J]. 中国生态农业学报, 2010, 18(4): 804–809. DOI: 10.3724/SP.J.1011.2010.00804 Liang S Z, Shi P, Ma W D, et al. Relational analysis of spectra and red-edge characteristics of plant leaf and leaf biochemical constituent[J]. Chinese Journal of Eco-Agriculture, 2010, 18(4): 804–809. DOI: 10.3724/SP.J.1011.2010.00804
-
期刊类型引用(2)
1. 蔡娜,葛莹,阮仁宗,李勇,庄翠珍. 基于经验正交变换的山地柑橘叶片光谱特征分析. 甘肃科学学报. 2023(02): 39-47 .  百度学术
百度学术
2. 高飞,王晓丽,胡林,樊景超,刘婷婷,闫燊,曹姗姗. 2016年辽宁兴城富士、华红、嘎啦苹果叶片光谱与图像数据集. 农业大数据学报. 2022(01): 109-113 .  百度学术
百度学术
其他类型引用(6)



 下载:
下载: